1. Phương pháp phân lập vi khuẩn
Phân lập là khâu quan trọng trọng trong quá trình nghiên cứu vi khuẩn. Mục đích của phân lập là tách riêng các vi khuẩn từ quần thể ban đầu tạo thành các clon thuần khiết để khảo sát và định loại. Khi vi khuẩn tăng trưởng và phát triển trên bề mặt môi trường rắn đã tạo ra những khuẩn lạc, hình thái của các khuẩn lạc mang tính đặc trưng của từng loài vi khuẩn. Việc mô tả chính xác các khuẩn lạc đã tách rời có thể góp phần rất quan trọng trong việc định danh vi khuẩn. Các nhà vi khuẩn học đã tiêu chuẩn hoá có ý nghĩa khi miêu tả hình dáng, độ cao và bờ, rìa của khuẩn lạc.
Hình thái khuẩn lạc
Điều quan trọng trong quá trình nuôi cấy vi sinh vật là tránh không đưa thêm vi sinh vật ngoại nhiễm vào môi trường nuôi cấy. Muốn vậy, ngoài các thao tác luôn phải được tiến hành trong điều kiện vô trùng, mọi yếu tố từ môi trường, dụng cụ chứa, dụng cụ nuôi cấy đến các vật dụng cần thiết khác đều phải được khử trùng thích hợp để được vô trùng trước khi sử dụng.
1.1. Các dạng mẫu cho nuôi cấy
- Dạng dịch mẫu đã được đồng nhất, dịch nuôi cấy hoặc môi trường lỏng chứa chủng vi sinh vật cần phântích.
- Dạng trên bề mặt môi trường rắn chứa thạch (1,5-2%) trong ống thạch nghiêng hay trong đĩa petri.
- Dạng mẫu nằm sâu trong môi trường rắn trong ống nghiệm thạch sâu chứa thạch mềm (0,5-0,7%).
1.2. Dụng cụ cấy
- Que cấy thẳng: Que cấy kim loại có đầu nhọn, thường dùng để cấy vi khuẩn có tạo khuẩn ty.
- Que cấy móc: que cấy có đầu vuông góc, thường dùng để cấy vi khuẩn có tạo khuẩn ty.
- Que cấy vòng (Que khuyên cấy): que cấy kim loại đầu có vòng tròn, thường dùng cấy chủng từ môi trường rắn hoặc lỏng lên môi trường rắn, lỏng.
- Que cấy trang: bằng kim loại hay thủy tinh, đầu hình tam giác, dùng để dàn trải vi khuẩn trên bề mặt thạch rắn.
- Ống hút thủy tinh dùng để chuyển một lượng vi khuẩn nhất định lên bề mặt môi trường rắn hoặc vào môi trường lỏng. Hiện nay, pipet cấy chuyển với những đầu tip vô trùng có thể tháo rời để thay đổi (còn gọi là pipet đầu rời hay transfer pipet dạng hút thông thường).
- Đầu tăm bông vô trùng để cấy giống từ môi trường lỏng lên bề mặt của môi trường rắn.
1.3. Các thao tác vô trùng
Thao tác cấy được thực hiện trong một không gian vô trùng tạo bởi ngọn lửa đèn cồn hoặc đèn Bunsen. Ngọn lửa đèn cồn, đèn Bunsen có tác dụng oxy hóa không khí tạo không gian vô trùng, đồng thời còn được dùng để đốt khử trùng que cấy, miệng chai lọ, ống nghiệm khi mở, đóng, nút bông, nắp nhựa…
Để tránh việc gây nhiễm thông qua tiếp xúc, nhân viên thao tác cần mang găng tay hoặc tiến hành sát trùng tay bằng cồn 70o hoặc các dung dịch diệt khuẩn, tương tự như vậy tiến hành sát trùng mặt bàn thao tác trước khi bắt đầu thao tác vô trùng. Sau khi hoàn tất việc cấy chủng, tiến hành sát trùng tay, mặt bàn làm việc tương tự như trên trước khi rời phòng kiểm nghiệm.
1.4. Kỹ thuật cấy ria trên đĩa petri
- Dùng que cấy vòng thao tác vô trùng nhúng vào dịch mẫu để có được các vi khuẩn cần phân lập.
- Ria các đường trên đĩa petri chứa môi trường thạch thích hợp. Sau mỗi đường ria liên tục, đốt khử trùng que cấy và làm nguội trước khi thực hiện đường ria tiếp theo.
- Lật ngược đĩa, ủ ở nhiệt độ và thời gian thích hợp trong tủ ấm.
1.5. Kỹ thuật cấy trang
- Dùng pipet chuyển 0,1ml dịch canh khuẩn lên bề mặt môi trường thạch trong đĩa pettri.
- Nhúng đầu thanh gạt vào cồn, hơ qua ngọn lửa để khử trùng. Để đầu thanh gạt nguội trong không gian vô trùng của ngọn lửa.
- Mở đĩa petri, đật nhẹ nhàng thanh gạt lên bề mặt thạch của đĩa petri. Dùng đầu thanh gạt trải đều dịch vi khuẩn lên bề mặt thạch. Trong khi thực hiện xoay đĩa một vài lần, mỗi lần khoảng nửa chu vi đĩa tạo điều kiện cho thanh gạt trải dịch vi khuẩn đều khắp bề mặt môi trường.
- Lật ngược đĩa, ủ ở nhiệt độ và thời gian thích hợp trong tủ ổn nhiệt.
2. Cấy chuyển
2.1. Cấy giống từ môi trường lỏng sang ống nghiệm chứa môi trường lỏng
- Đốt nóng đỏ đầu que cấy trong ngọn lửa và hơ nhẹ phần cán (phần sẽ đưa vào bên trong dụng cụ chứa vi sinh vật). Cầm thẳng đứng que cấy cho que cấy nóng đều.
- Tay trái cầm ống nghiệm xoay nhẹ, tay phải cầm que cấy. Ngón út của tay phải dùng để mở nút bông.
- Mở nút bông xoay miệng ống nghiệm qua ngọn lửa.
- Đưa que cấy đã khử trùng vào bên trong ống nghiệm, làm nguội que cấy bằng cách áp đầu que cấy vào thành ống cho nguội. Thu sinh khối bằng cách nhúng que cấy vào môi trường lỏng, rút thẳng que cấy ra không để dính vào thành và miệng ống. Hơ nóng miệng ống nghiệm, đậy nút bông. Đặt ống nghiệm vào giá đỡ.
- Đầu que cấy có chứa vi khuẩn được giữ ở vùng không khí vô trùng gần ngọn đèn. Dùng tay trái lấy ống nghiệm chứa môi trường mới, mở nút bông, khử trùng miệng ống nghiệm rồi đưa đầu que cấy vào bên trong môi trường.
- Nhúng và khuấy nhẹ que cấy trong dịch môi trường để tách sinh khối ra khỏi đầu que cấy.
- Rút thẳng đầu que cấy ra. Khử trùng miệng ống nghiệm, đậy nút bông lại.
- Khử trùng que cấy ngay sau khi cấy xong.
2.2. Cấy giống từ môi trường lỏng sang ống thạch nghiêng
Tiến hành tương tự như trên với một số khác biệt sau: cấy giống lên bề mặt thạch nghiêng bằng cách đặt nhẹ đầu que cấy lên bề mặt môi trường ở đáy ống, sau đó cấy theo hình chữ chi từ đáy ống nghiệm lên đến đầu trên của mặt thạch nghiêng.
2.3. Cấy giống từ môi trường lỏng bằng pipet đầu rời
Pipet đầu rời cho phép thao tác chính xác với những dung tích nhỏ. Trong thao tác vô trùng, pipet đầu rời rất hữu dụng vì cho phép cấy chuyển dễ dàng dịch vi khuẩn lên bề mặt môi trường rắn trong đĩa petri nhằm tạo khuẩn lạc rời hoặc vào ống nghiệm hay bình chứa môi trường lỏng để nuôi tăng sinh. Bằng một pipet đầu rời người ta có thể thực hiện với số lần không hạn chế các thao tác vô trùng này do có thể hấp khử trùng đồng loạt với số lượng lớn các đầu tip. Trước khi sử dụng, kiểm nghiệm viên cần biết các yêu cầu cơ bản khi thao tác với pipet đầu rời như sau:
- Mỗi pipet đầu rời đều có giới hạn dung tích thao tác cho phép nhất định. Thông thường các dải dung tích đó là: 0,1 ml, 1- 20 ml, 20- 200 ml, 0,2- 1 ml, 1-5 ml, 1- 10 ml. Dải dung tích thao tác cho phép này thường được ghi rõ trên pipet đầu rời. Trong dải dung tích cho phép, kiểm nghiệm viên có thể điều chỉnh để có dung tích chính xác cần thao tác. Cần chọn pipet đầu rời với giới hạn dung tích thích hợp cho phạm vi thao tác. Mỗi loại pipet đầu rời đều có đầu tip tương ứng và có thể được khử trùng bằng nồi hấp áp suất.
- Pipet đầu rời thường có hai nấc: nấc 1 tương đương với dung tích được chọn sử dụng khi hút dung dịch, nấc 2 vượt quá nấc 1 được sử dụng khi bơm dung dịch ra khỏi đầu tip của pipet đầu rời.
- Khi sử dụng pipet đầu rời để cấy chuyển dịch giống cần tiến hành thao tác trong không gian vô trùng của ngọn lửa trong tủ cấy.
- Tay phải cần pipet đầu rời, tay trái mở hộp chứa đầu tip vô trùng. Cắm đầu pipet vào đầu tip.
- Dùng tay trái giữ ống nghiệm, bình chứa dịch giống vi sinh vật. Dùng ngón út và áp út của tay phải đang giữ pipet để kẹp giữ và mở nút bông, hơ nóng khử trùng miệng ống nghiệm hoặc bình chứa.
- Đưa đầu tip vô trùng vào bên trong dịch giống, hút lấy dung tích cần thiết.
- Rút đầu tip ra khỏi miệng bình chứa, khử trùng miệng bình chứa và đậy bằng nút bông đang được giữ ở ngón út và áp út của tay phải.
- Đầu tip có chứa vi sinh vật được giữ ở vùng không khí vô trùng gần ngọn đèn.
- Dùng tay trái lấy ống nghiệm hoặc bình chứa môi trường mới, dùng ngón út và áp út kẹp và mở nút bông, khử trùng miệng bình chứa.
- Đưa đầu tip vào bên trong môi trường và bơm dịch giống vào môi trường.
- Rút đầu tip ra khỏi miệng bình chứa, khử trùng miệng bình, đậy nút bông.
- Thay đầu tip vô trùng mới khi thực hiện đợt cấy tiếp theo.
- Thực hiện tương tự trong trường hợp cấy chuyển dịch giống lên bề mặt môi trường trong đĩa petri.
- Cần lưu ý đầu pipet đầu rời và đầu tip được chế tạo bằng polymer nên tuyệt đối khử trùng đầu pipet và đầu tip bằng ngọn lửa.
Để đảm bảo sự phát triển của vi khuẩn, sau khi cấy xong phải quan tâm đến các điều kiện môi trường nuôi vi khuẩn bao gồm: (1) Nhiệt độ, phải chọn nhiệt độ tối ưu cho sự phát triển của mỗi loài vi khuẩn và duy trì ổn định nhiệt độ đó; (2) Độ ẩm, để duy trì độ ẩm trong quá trình nuôi ủ, cần đảm bảo đủ lượng nước khi làm môi trường. (3) Khí oxy đối với vi sinh vật hiếu khí, lớp môi trường nuôi cấy có độ dày vừa phải để oxy không khí có thể thấm vào.
3. Quy trình nhân giống và bảo quản chủng vi sinh vật chuẩn
3.1. Nguồn gốc
Chủng chuẩn cung cấp cho phòng thí nghiệm phải có nguồn gốc từ các nhà cung cấp hay tổ chức cung cấp giống vi khuẩn có uy tín, có chức năng cung cấp chủng giống vi khuẩn.
Giống được cung cấp phải đảm bảo yêu cầu về chất lượng, hoạt tính, có thông tin về các đặc điểm về sinh hóa, tính chất kháng nguyên.
Khi được nhà cung cấp chuyển đến phòng thí nghiệm các ống chủng vi khuẩn phải có nhãn ghi đầy đủ tên, mã số, ký hiệu chủng loại kèm theo hướng dẫn bảo quản, số lần cấy chuyền (số thế hệ) và các đặc điểm sinh hóa, kháng nguyên.
3.2. Nhân giống và bảo quản
Chủng giống dạng đông khô từ các ngân hàng giống được coi là giống gốc. Từ đây chủng được nhân lên trong môi trường canh thang (lần cấy chuyền thứ nhất).
Vi sinh vật từ môi trường canh thang được cấy chuyển vào môi trường thạch dinh dưỡng Tryptose Soy Agar (TSA – 1 đĩa và 15 ống thạch nghiêng) và môi trường chọn lọc.
- Môi trường thạch không chọn lọc: ủ ở 370C 24 giờ, kiểm tra độ thuần chủng trên đĩa TSA. Số lượng ống chủng phụ thuộc vào nhu cầu của phòng. Kiểm tra lại và loại bỏ những ống củng không đạt yêu cầu. Bảo quản các ống chủng ở 40C, thời gian bảo quản tối đa là 3 tháng. Các chủng này được dùng làm đối chứng trong các lần phân tích mẫu.
- Môi trường thạch chọn lọc: cấy chủng từ môi trường canh thang trên lên môi trường thạch chọn lọc. Sau khi ủ, chọn một số khuẩn lạc để kiểm tra lại mức độ thuần khiết, các đặc tính sinh hóa và đặc tính kháng nguyên.
Khi ống chủng sắp hết thời gian bảo quản cho một lần cấy chuyển, các chủng giống được nhân lên trong môi trường canh thang dinh dưỡng và cấy chuyền vào các ống thạch nghiêng để bảo quản tương tự như trên.
Với một chủng vi khuẩn chuẩn chỉ được cấy tối đa 5 lần kể từ lần nhân giống đầu tiên. Sau mỗi lần cấy chuyển đều phải kiểm tra lại hoạt tính và độ thuần chủng. Khi hết thời hạn cấy chuyển phải thay chủng giống mới.
3.4. Sử dụng chủng chuẩn trong phân tích mẫu
Các chủng chuẩn trong môi trường thạch nghiêng trước khi sử dụng làm mẫu chứng dương được cấy sang môi trường thạch đĩa không chọn lọc (Plate Count Agar, Tryptose Soy Agar hay Nutrien Agar) nhằm kiểm tra độ thuần khiết, các đĩa này được bảo quản và sử dụng trong một tuần.
3.5. Chú ý khi sử dụng chủng chuẩn
Các chủng chuẩn phải được sử dụng và bảo quản cẩn thận ở 40C, mỗi ống chủng phải có nhãn mác ghi các thông tin như: tên, ký hiệu chủng, ngày, số lần cấy chuyển…
Kiểm nghiệm viên phải thận trọng và tuân thủ các quy định về an toàn phòng kiểm nghiệm khi cấy chuyển thao tác với các chủng chuẩn để tránh nhiễm bệnh hay làm lây lan mầm bệnh.
Dụng cụ sau khi tiếp xúc với các chủng vi khuẩn phải đựơc thanh trùng cẩn thận. Dụng cụ thủy tinh và các đĩa petri sau khi dùng phải được hấp khử trùng ở 121oC 20 phút trước khi đem rửa, dụng cụ thủy tinh được ngâm trong dung dịch chlorin, sau đó rửa bằng xà phòng và tráng lại bằng nước sạch trước khi phơi khô.
4. Phương pháp soi tươi
Có thao tác đơn giản, tiến hành nhanh, thường được sử dụng để quan sát trạng thái sống của tế bào vi khuẩn.
4.1. Phương pháp thực hiện
4.1.1. Dụng cụ
- Lam kính: dùng làm tiêu bản.
- Lam phủ (lamel, kính phủ vật): dùng để đậy lên các tiêu bản.
- Lam kính lõm: dùng để quan sát khả năng di động của vi khuẩn.
4.1.2. Chuẩn bị giọt canh khuẩn từ môi trường nuôi cấy
- Đặt ống chứa vi khuẩn vào giữa ngón cái và ngón trỏ của bàn tay trái, lòng bàn tay ngửa ra, ống nghiệm để hơi nghiêng nhưng không được để cho canh khuẩn chạm vào nút bông của ống nghiệm nuôi cấy vi khuẩn.
- Khử trùng que cấy trên ngọn đèn cồn. Để que cấy thẳng đứng trên ngọn lửa cho đến khi đầu que cấy nóng đỏ rồi từ từ đặt và di chuyển que cấy theo chiều nằm ngang trên ngọn lửa.
- Kẹp nút bông vào giữa ngón út và lòng bàn tay phải, xoay nhẹ nút một vòng và kéo nút ra. Giữ nút như vậy cho đến khi đậy nút vào.
- Đốt miệng ống nghiệm trên ngọn lửa đèn cồn.
- Đưa que cấy đã nguội vào ống nghiệm để lấy mẫu. Nếu ống giống là môi trường lỏng thì chỉ cần nhúng đầu que cấy vào canh trường rồi rút ra. Nếu giống mọc trên môi trường đặc thì dùng que cấy lấy một ít sinh khối vi sinh vật trên mặt thạch và hòa đều vào giọt nước cất vô trùng trên lam kính. Chú ý thao tác hết sức nhẹ nhàng để khi lấy mẫu vi khuẩn không làm rách mặt thạch.
- Rút que cấy ra, đốt miệng ống nghiệm, đậy ống nghiệm lại và đặt ống
vào giá.
- Đặt giọt canh khuẩn (hoặc sinh khối vi sinh vật) ở đầu que cấy vào giữa phiến kính để làm tiêu bản.
- Khử trùng lại que cấy trên ngọn đèn rồi cất vào giá.
4.1.3. Tiêu bản giọt ép
- Dùng que cấy hoặc ống hút káy giống vi sinh vật để làm vết bôi.
- Đặt một mép kính phủ vật tiếp xúc với lam kính một góc 450 rồi từ từ hạ xuống phủ giọt canh khuẩn thật nhẹ nhàng, tránh không tạo thành bọt khí.
4.1.4. Tiêu bản giọt treo
Dùng phiến kính đặc biệt có phần lõm hình tròn ở giữa.
- Cho một giọt canh khuẩn lên giữa kính phủ vật. Thận trọng xoay ngược lá kính cho giọt canh khuẩn quay xuống phía dưới rồi đặt lên phần lõm của phiến kính.
- Chú ý không giọt canh khuẩn lan rộng hay chạm vào đáy của phần lõm.
- Đặt tiêu bản lên kính hiển vi và quan sát ở vật kính 10x hoặc 40x.
Trên thị trường hiện nay đã xuất hiện một dụng cụ có tên gọi là vòng O (O-ring) dùng để thực hiện giọt treo mà không cần lam kính lõm. Đây là một miếng đệm hình tròn, có kích thước vòng trong 12 mm, cao 3 mm có thể sử dụng nhiều lần. Khi thực hiện, người ta đặt vòng O lên giữa lam kính thường, đưa giọt canh khuẩn vào một mặt của kính phủ vật, xoay ngược kính phủ vật và úp lên vòng O. Đây là cải tiến của nhà sản xuất Science Kit, một bộ O- ring 25 chiếc có giá khoảng 20 USD.
5. Phương pháp nhuộm gram
Năm 1884, Hans Christian Joachim Gram, một nhà khoa học người Đan Mạch đã sáng chế ra phương pháp nhuộm vi khuẩn mới mà ngày nay tên gọi đã trở lên rất quen thuộc với mọi phòng thí nghiệm vi khuẩn thế giới:
Phương pháp nhuộm gram là một trong những kỹ thuật cơ bản và quan trọng nhất trong phân tích vi khuẩn ở giai đoạn đầu nhằm xác định sơ bộ đặc tính của các dòng vi khuẩn muốn nghiên cứu theo tính chất bắt mầu gram của chúng. Vi khuẩn bắt mầu hỗn hợp crystal violet - iodin sẽ có màu tím nâu khi quan sát dưới kính hiển vi quang học và được xếp vào nhóm vi khuẩn gram dương. Những dòng vi khuẩn khác không giữ được mầu crystal violet và bắt mầu fuchsin (đỏ) được xếp vào nhóm vi khuẩn gram âm.
Phương pháp nhuộm gram dựa vào khả năng lưu giữ crystal violet của thành tế bào các dòng vi khuẩn sau khi bị tẩy bằng cồn. Việc xác định thời gian tẩy mầu là yếu tố quan trọng trong việc phân biệt vi khuẩn gram dương và vi khuẩn gram âm. Nếu kéo dài thời gian tẩy mầu, ngay cả vi khuẩn gram dương cũng không giữ được mầu nhuộm ban đầu. Ngoài ra, một số loài vi khuẩn gram dương cũng có thể bị tẩy mầu dễ dàng và vì thế chúng được coi là các dòng vi khuẩn có tính chất bắt mầu gram thay đổi (có thể âm lẫn dương). Chất nhuộm fuchsin (hoặc có thể thay bằng safranin) tạo cho vi khuẩn gram âm có mầu hồng đỏ. Fuchsin nhuộm mầu mạnh hơn và có mầu dễ nhìn hơn safranin. (Haemophilus spp., và một vài dòng vi khuẩn kỵ khí không ăn màu safranin)
5.1. Kỹ thuật nhuộm gram
5.1.1. Pha dung dịch thuốc nhuộm
a) Dung dịch Cristal violet:
* Dung dịch A:
- Crystal violet………………2 g
- Ethanol 95% ………………20 ml
* Dung dịch B:
- Ammonium oxalat …………………0,8
- Nước cất……………………………..80 ml
Trộn đều 2 dung dich A và B, lọc qua giấy lọc thô, giữ ở nhiệt độ phòng trong chai mầu nâu.
b) Dung dịch Lugol:
- Indin tinh thể……………………….1 g
- Potasium iodid……………………...2 g
- Nước cất..............................................300 ml
Nghiền Iodin vào Potassium iodid trong 50 ml nước cất cho hòa tan hoàn toàn. Thêm phần nước cất còn lại, giữ ở nhiệt độ phòng trong chai nâu. Khi dung dịch mất mầu phải pha lại.
c) Dung dịch Carbon fuchsin:
* Dung dich A:
- Fuchsin………………………………0,3 g
- Ethanol 95%........................................10 ml
* Dung dịch B
- Phenol nóng chảy…………………….5 ml
- Nước cất………………………………95 ml
Trộn đều dung dịch A và dung dich B, lọc qua giấy lọc thô.
d) Dung dịch Acid Alcohol:
- HCL…………………………………..3 ml
- Ethanol cho đủ………………………..100 ml
5.1.2. Cố định phiến phết
a) Từ môi trường lỏng
- Dùng bút sáp để ghi tên mẫu hoặc số nhận diện, ngày thử nghiệm. Vẽ vòng tròn để giới hạn vùng phiến phết vi khuẩn.
- Dùng khuyên cấy lấy một khuyên dịch khuẩn, dàn đều thành lớp mỏng giới hạn trong vòng tròn đã vẽ trên lam kính. Để dịch khuẩn tự khô hoàn toàn.
- Hơ mặt dưới của lam kính qua lai trên ngọn lửa 2- 3 lần, tránh không để tiêu bản quá nóng.
b) Từ môi trường rắn
- Dùng bút sáp để ghi tên mẫu hoặc số nhân diện, ngày thử nghiệm. Vẽ vòng tròn để giới hạn vùng phiến phết vi khuẩn.
- Dùng khuyên cấy lấy một khuyên cấy nước cất vô trùng đặt vào giữa vòng tròn đã vẽ, lấy một lượng nhỏ vi khuẩn từ khuẩn lạc và dàn mỏng với nước cất trong vòng tròn. Để dịch khuẩn tự khô hoàn toàn.
- Hơ mặt dưới của lam kinh qua lại trên ngọn lửa 2 đến 3 lần, tránh không để tiêu bản quá nóng.
5.1.3. Tiến hành nhuộm
- Phủ dung dịch lên lam kính đã được cố định trong 1 phút.
- Đổ bỏ dung dịch Crustal violet và rửa với nước cất.
- Phủ dung dịch làm cắn màu lugol trong 1 phút, sau đó đổ bỏ dung dịch lugol và rửa nhẹ với nước.
- Cầm một đầu lam kính, nhỏ từ từ cồn 950 cho đến khi vùng phiến kính bạc màu di ( thời gian tẩy cồn thông thường từ 10-15 giây). Rửa ngay với nước để chấm dứt công đoạn tẩy màu.
- Phủ dung dịch fuchsin lên lam kính 30 giây, đổ bỏ dung dịch và rửa qua nước.
- Dùng giấy thấm để thấm khô hoặc để khô tự nhiên. Khảo sát hình thể và tính chất bắt mầu của vi khuẩn dưới kính hiển vi với vật kính dầu.
5.2. Nguyên nhân một số sai lệch trong phương pháp nhuộm gram
5.2.1. Gram dương trở thành gram âm
- Lứa cấy quá già: vi khuẩn trong quá trình biến dưỡng sinh ra một số chất có khả năng làm tăng tính acid của môi trường nuôi cấy gây sai lệch kết quả. Tốt nhất lên nhuộm gram với lứa cấy từ 18-24 giờ.
- Dung dịch Lugol bị hỏng: phải bảo quản dung dịch lugol trong chai nâu, tránh ánh sáng và cần loại bỏ ngay khi thấy dung dịch chuyển màu từ nâu sang vàng.
- Tẩy màu quá mức: nhỏ quá nhiều cồn hoặc không rửa nước ngay.
5.2.2. Gram âm trở thành gram dương
- Cố định tiêu bản khi còn ướt, các hợp chất protein có trong môi trường họăc trong mẫu thử làm tiêu bản khó tẩy màu.
- Tẩy màu chưa đạt.
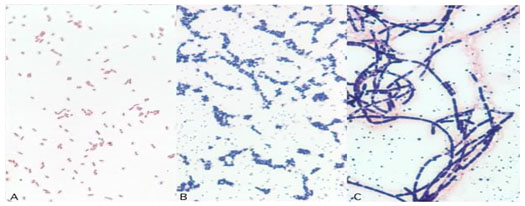 Phản ứng với thuốc nhuộm của các chủng vi khuẩn
Phản ứng với thuốc nhuộm của các chủng vi khuẩn
A: E. coli, gram (-)
B: Staphylococcus epidermidis, Gram (+)
C: Bacillus cereus, Gram (+).
6. Các thử nghiệm sinh vật hoá học
6.1. Lên men đường
Thử nghiệm lên men trong môi trường canh thang có chứa đường, pepton và cao thịt (để cung cấp các dinh dưỡng phụ cho các vi sinh vật khó lên men), và chất chỉ thị mầu tía cresol brom (chất chỉ thị pH). Nếu có sự lên men đường, thường sinh ra acid. Trường hợp này pH môi trường giảm xuống đã làm cho màu tía cresol brom chuyển từ xanh sang vàng. Cũng như vậy, nếu thêm ống Durham, sẽ cho phép xác định sự sinh hơi (H2) từ quá trình lên men. Kết quả trả lời cuối cùng là sinh acid (+/-) và gas (+/-).
Phản ứng lên men trong MT canh thang:
Nếu vi khuẩn không lên men với test đường thì thuốc nhuộm màu tía vẫn còn lại và không sinh gas (trái). Nếu quả trình lên men xảy ra, hầu hết là sinh ra acid, khi đó pH giảm và làm đổi màu của canh thang sang màu vàng (giữa). Nếu sinh gas, ống Durham ở trong đảo ngược lên và nhìn như có bong bóng (phải).

6.2. Thủy phân tinh bột
Đĩa thạch tinh bột được sử dụng để thử tính chất thủy phân tinh bột ngoại bào. Tinh bột là 1 phân tử polysacchrid có trọng lượng quá lớn để có thể dịch chuyển vào trong tế bào mà bước đầu không cần bẻ gãy thành những đơn vị nhỏ hơn. Khả năng thủy phân tinh bột phụ thuộc vào sự sản xuất và bài tiết một số men để giáng phân polymer. Sự phá vỡ tinh bột được nhận thấy sau khi ủ ngập đĩa với iod. Phức hợp iod với tinh bột nguyên chất có màu xanh. Nếu vi khuẩn có khả năng phá hủy tinh bột, không có phản ứng xảy ra và ta thấy xuất hiện một vùng trống (không màu) quanh khuẩn lạc.
Thủy phân tinh bột:
Các vi khuẩn có khả năng sử dụng tinh bột để tiết ra men amylase, men này được dùng để thủy phân tinh bột. Quá trình tinh bột bị phá vỡ được quan sát thấy khi ta ngâm đĩa tinh bột với iod, quá trình đó đã tạo ra phức hợp màu tía.
Các vi khuẩn thử nghiệm không có khả năng phá vỡ tinh bột sẽ tạo ra đường viền đầy đủ do một vùng màu tía (trái). Khi tinh bột bị phá vỡ sẽ tạo ra một vùng sáng xung quanh đường cấy, trong khi nền của đĩa là màu tía (phải).
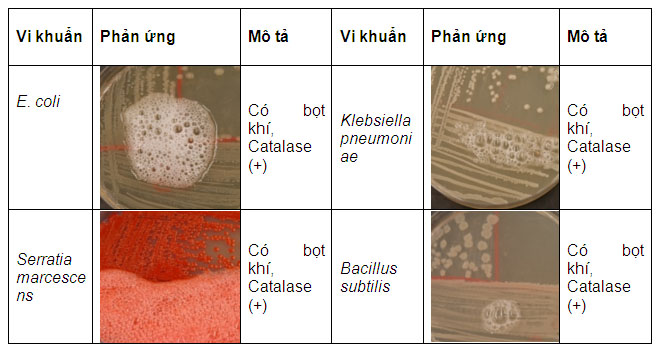
6.3. Thử nghiệm Catalase
Môi trường thạch tim (HIA) được sử dụng như một môi trường cho nhiều mục đích, như để xác nhận hình thái khuẩn lạc và phản ứng catalase. Trong suốt quá trình chuyển hoá oxy được tạo ra đã làm nhiễm độc các tế bào, khi đó các enzym đặc biệt của vi khuẩn được tạo ra để giải độc những hợp chất đó. Một trong các enzym đó là catalase có tác dụng phân giải H2O2 tạo thành oxy và nước. Đây là một thử nghiệm dễ dàng để phát hiện enzym này trong vi khuẩn khi sử dụng H2O2 3%.
Phản ứng catalase với các chủng thử nghiệm
6.4. Giáng hoá tryptophan thành Indole
Canh thang Tryptone chứa nồng độ cao amino acid tryptophan. Một số vi sinh vật có khả năng phân hủy tryptophan thành indole và khả năng này được dùng để phân biệt các vi khuẩn. Thử nghiệm được thực hiện bằng cách thêm chất thử Kovac vào canh cấy, kết quả là nếu xuất hiện indole thì sẽ có vòng màu đỏ ở phía trên của canh cấy. Ví dụ, phản ứng dương tính và âm tính của thử nghiệm indole trong hình 7.
Quá trình giáng hoá indole
Dương tính cho 1 vòng tròn máu đỏ phía trên môi trường (trái), âm tính là 1 vòng tròn mầu nâu hoặc trong mờ đục (phải).
Việc xác định các vi sinh vật bằng các thử nghiệm hoá sinh trên đã được thực hiện qua nhiều thế kỷ và đã được tiêu chuẩn hoá. Để các thử nghiệm này được tiến hành thuận lợi hơn, các nhà sản xuất đã chế tạo ra những bộ kit chẩn đoán nhanh để định danh vi khuẩn, ví dụ như strip Api 20.
Các phản ứng sinh hoá trên bộ Api-20
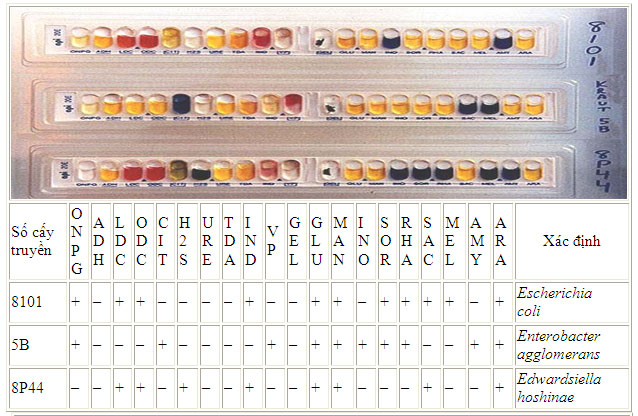
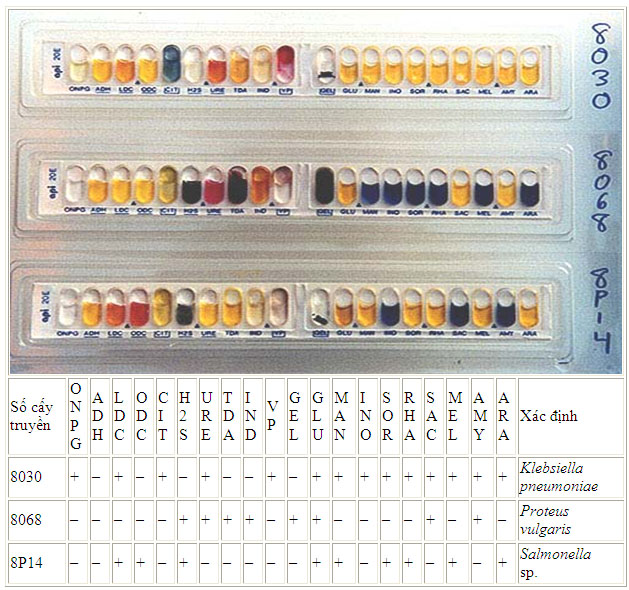
Các thử nghiệm hoá sinh ở đây đã được nghiên cứu và thu nhỏ. Strip Api-20 là một ví dụ về các thử nghiệm loại này, mỗi Strip có 20 test được thực hiện bằng phương thức đơn giản giúp tiết kiệm thời gian và kinh phí. Thử nghiệm đầu tiên giúp nhận biết sự có mặt của enzyme õ-galatosidase, đây là enzym có liên quan tới quá trình dị hoá lactose. Ba phản ứng tiếp theo (theo thứ tự là arginin, lysin and ornithin) là thử nghiệm tách carboxyl của amino acid. Phản ứng decarboxyl được cho thấy bằng 1 phản ứng kiềm (màu đỏ của chất chỉ thị đặc hiệu được sử dụng). Chín thử nghiệm tiếp theo là xác định sự lên men carbohydrat (glucose, mannitol, inositol, sorbitol, rhamnose, sucrose, melibiose, amygdalin và arabinose). Sự lên men được thể hiện bằng 1 phản ứng acid (màu vàng của chất chỉ thị). Sự có mặt của sản phẩm H2S và gelatin hydrolysis (GEL) được thể hiện bằng mầu đen bao phủ khắp ống. Phản ứng dương tính của tryptophan deaminase (TDA) thể hiện bằng màu nâu sẫm khi thêm thuốc thử là FeCl3. Kết quả dương tính của test này giống với phản ứng dương tính của phenylalanin và lysie deaminase, là những phản ứng đặc trưng của Proteus, Morganella and Providencia.
7. Các kỹ thuật phát hiện kháng thể, kháng nguyên và AND của vi khuẩn
Một trong những hạn chế của các thử nghiệm sinh hoá là vi sinh vật phải phát triển trên một vài môi trường nào đó và thời gian cần ít nhất là 12 - 24 giờ để đọc kết quả. Trên thực tế, các chủng thử nghiệm có thể bị đột biến cho nên không thực hiện được chuyển hoá bình thường như chủng chuẩn khác, ví dụ hầu hết các loài E.coli có khả năng sử dụng lactose như 1 nguồn carbon, tuy nhiên những E.coli phân lập được lại không có khả năng sử dụng lactose. Mặt khác, trong một số trường hợp nuôi cấy phân lập vi khuẩn có thể bị thất bại do việc sử dụng kháng sinh để điều trị. Để khắc phục những nhược điểm này, các kỹ thuật phát hiện kháng nguyên, kháng thể và vật liệu di truyền của vi khuẩn là những công cụ hữư hiệu nhất ngày càng được sử dụng rộng rãi.
7.1. Các kỹ thuật phát hiện kháng nguyên
- Kỹ thuật ngưng kết hạt (Partical Agglutination).
- Thử nghiệm kết tủa (Precipilin Tests).
- Kỹ thuật nhuộm với kháng thể gắn huỳnh quang.
- Thử nghiệm miễn dịch pha rắn với kháng thể gắn enzym.
7.2. Các kỹ thuật phát hiện kháng thể
- Kỹ thuật ngưng kết hạt (Partical Agglutination).
- Kỹ thuật tủa (Precipitation Assay).
- Kỹ thuật kết hợp bổ thể (Complêmnt Fixation test).
- Kỹ thuật miễn dịch gắn enzym.
- Kỹ thuật Western Blotting.
TÀI LIỆU THAM KHẢO
1. Lê Huy Chính. Vi sinh Y học. Nhà xuất bản Y học. 2001. 12 - 37, 100 - 119.
2. Diagnostic Microbiology. Connie R., Mahon M.S., Giorge Manuselis J.R., W.B Saunder Company.1995.
3. Diagnostic Procudures for Bacterial, Mycotic, and parasitic infections, 5th. Bodily. Howard L., Ypdyke, Elaine L, Jame O. American Public Health Association, Inc, New York, 1970.