VIÊM PHỔI DO SARS-COV 2
NGUYỄN VĂN THÀNH (*)
Tóm tắt:
Sau khoảng 2 năm tiếp cận đại dịch do SARS COV-2, y học đã có những bước tiến dài trong sự hiểu biết về sinh bệnh học, chẩn đoán và điều trị viêm phổi do SARS COV-2. Mặc dù vậy, vẫn còn nhiều câu hỏi về bệnh học và cách ứng xử viêm phổi do SARS COV-2 trong thời gian tới cần được làm sáng tỏ. Trong xử trí, do tình hình cấp bách của dịch bệnh, nhiều thuốc và cách tiếp cận xử trí đã được phê duyệt khẩn cấp không theo quy trình chuẩn đang đòi hỏi cần có các đánh giá kịp thời để bổ sung cho những khoảng trống mà y học còn chưa biết. Một trong những vấn đề rất được quan tâm và cần được làm sáng tỏ là tác động lâu dài sau viêm phổi do SC-2 như thế nào trên người khỏe cũng như trên người có bệnh phổi mạn tính. Đây là bệnh mới nổi, tiếp cận thực hành còn nhiều tranh luận và vẫn còn tiếp tục được các nghiên cứu cập nhật. Bài viết này nhằm tổng quan y văn tới thời điểm tháng 9 năm 2021 về viêm phổi do SARS COV-2 từ bệnh học tới xử trí.
Summary:
SARS-CoV-2 pneumonia
After about 2 years of approaching the pandemic caused by SARS COV-2, medicine has made great strides in understanding the pathogenesis, diagnosis and treatment of SARS COV-2 pneumonia. However, there are still many questions about the pathology and treatment of SARS COV-2 pneumonia in the near future that need to be clarified. In management, due to the urgency of the epidemic, many urgently approved drugs and management approaches that do not follow standard procedures are requiring timely assessments to fill in the gaps that the medicine is still unknown. One of the issues of great interest and need to be elucidated is the long-term effects of SARS COV-2 pneumonia in healthy individuals as well as in people with chronic lung diseases. This is an emerging disease, the approach to practice is controversial and continues to be updated by research. This paper aims to review the literature up to September 2021 on SARS COV-2 pneumonia from pathology to management.
ĐẶT VẤN ĐỀ
Vào cuối tháng 12 năm 2019, Trung Quốc báo cáo những ca viêm phổi không rõ nguyên nhân đầu tiên xuất hiện ở Vũ Hán (tỉnh Hồ Bắc, Trung Quốc). Vào đầu năm 2020, căn nguyên viêm phổi của những trường hợp viêm phổi như trên đã được xác định là một loại coronavirus mới phát hiện và virus này được đặt tên là virus corona mới phát hiện lần đầu năm 2019 (2019 novel coronavirus – 2019- nCoV). Sau đó WHO đổi tên virus này thành SARS-CoV-2 do virus có những đặc điểm giống với virus gây hội chứng suy hô hấp cấp (SARS - severe acute respiratory syndrome) trong dịch năm 2003 (đã được gọi là SARS-CoV-1) hay COVID-19 (Coronavirus Infectious Disease 2019). Ngày 11 tháng 3 năm 2020, WHO đã công bố đại dịch và tình trạng y tế công cộng khẩn cấp. Cũng từ thời điểm này, thông tin từ từ khóa SARS COV-2 (hay COVID-19) là mạnh nhất, chiếm hầu hết dung lượng thông tin y học quốc tế. Ở Việt Nam, cũng đã có một số bài viết và công bố nghiên cứu dịch tễ, lâm sàng và hướng dẫn thực hành. Nhiễm SARS COV-2 (SC-2) tạo ra một phổ bệnh cảnh lâm sàng rộng, từ không triệu chứng tới hội chứng suy hô hấp cấp. Tình trạng nhiễm trùng không triệu chứng có thể thấy ở 85% các trường hợp [1]. Trong số bệnh nhân có triệu chứng, 80% là diễn biến nhẹ, 15% là nặng và 5% là nguy kịch [1]. Tỷ lệ tử vong chung khoảng 3,2% [2]. SC-2 có thể gây bệnh ở tất cả các lứa tuổi [3]. Đây là bệnh mới nổi, tiếp cận thực hành còn nhiều tranh luận và vẫn còn tiếp tục được các nghiên cứu cập nhật. Bài viết này nhằm tổng quan y văn tới thời điểm tháng 9 năm 2021 về viêm phổi do SC-2 từ bệnh học tới xử trí.
SINH BỆNH HỌC
Coronavirus là thành viên của họ Coronaviridae và phân họ Coronavirinae, bao gồm bốn chi Alphacoronavirus, Betacoronavirus, Gammacoronavirus và Deltacoronavirus. Bốn chi này được tạo ra dựa trên cùng cấu trúc hệ gen và các mối quan hệ phái sinh loài (phylogenetic). SC-2 thuộc chi Betacoronavirus và lây bệnh cho người được cho là từ động vật, nhiều khả năng từ loài dơi [4]. SC-2 có trình tự gen rất giống, giống đến 80% so với SARS-CoV-1 (SC-1) và 96.2% so với coronavirus dơi (RaTG13) [5]. Vỏ virus được bao bọc bởi gai (spike, S) lipoprotein, lớp vỏ (envelope, E) và màng (membrane, M) protein. Virus kết hợp với tế bào vật chủ thông qua protein gai. Bước đầu tiên của quá trình lây nhiễm là virus kết hợp với các tế bào vật chủ thông qua các thụ thể đích. Phân nhóm S1 protein có chứa thụ thể kết hợp với peptidase của men chuyển angiotensin 2 (angiotensin- converting enzyme 2, ACE 2). Trên SC-2 có phân nhóm S2 protein được bảo quản tốt (highly preserved) và là mục tiêu kháng virus tiềm năng. Cấu trúc và quá trình xâm nhập của SC-2 được trình bày trong hình 1. SC-2 sở hữu một số đặc tính sinh học lợi thế so với SC-1 nên khả năng gây bệnh cao hơn. SC-2 có hệ số nhân lên (reproductive number, R0) cao hơn SC-1. Mặc dù cùng có thụ thể đích ưu tiên là thụ thể men chuyển ACE 2 nhưng sự khác biệt của cấu trúc protein bề mặt SC-2 làm cho virus có khả năng gắn kết với thụ thể mạnh hơn và xâm nhập vào tế bào vật chủ hiệu quả hơn. SC-2 cũng có ái lực với các tế bào kết mạc, niêm mạc đường hô hấp mạnh hơn [6-8]. Động học và tải lượng virus có thể giải thích một số khác biệt về khả năng gây bệnh giữa SC-1 và SC-2. Tải lượng virus trên đường hô hấp của SC-2 đạt đỉnh vào ngày xuất hiện triệu chứng và 1 tuần tiếp theo và đây cũng là thời điểm có khả năng lây bệnh cao nhất do vừa kết hợp với số lượng lớn virus vừa có triệu chứng để phát tán. Trong khi đối với SC-1 tải lượng virus đạt đỉnh muộn hơn, thường là sau 2 tuần kể từ khi có triệu chứng [9].
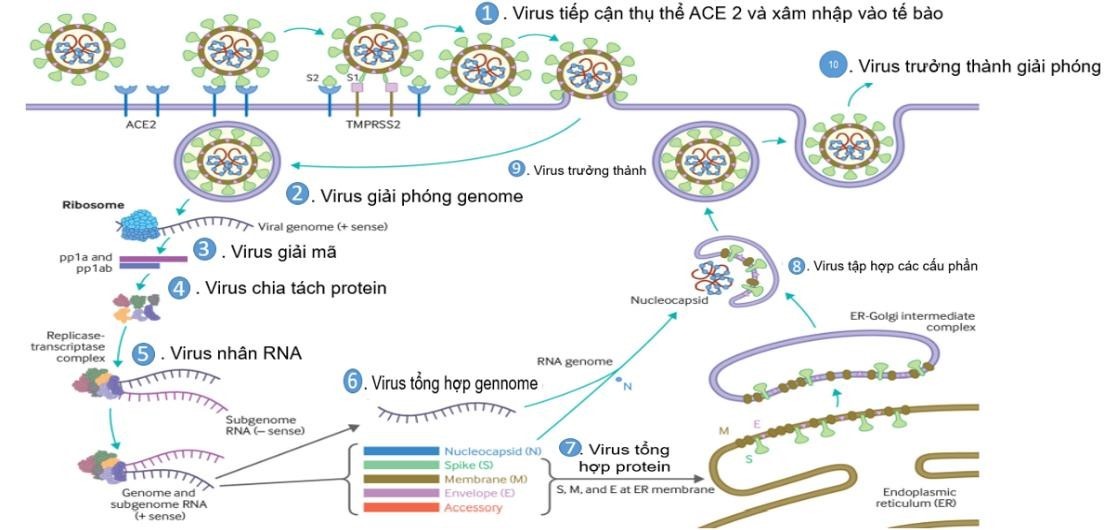
Hình 1. (1) Virus liên kết với ACE 2 như là thụ thể của tế bào đích trên vật chủ bằng sự hiệp đồng với protease 2 serine xuyên màng (protein bề mặt tế bào) của vật chủ, thụ thể được trình diện chủ yếu trên các tế bào biểu mô đường thở và tế bào nội mô mạch máu. (2) Quá trình này này dẫn đến sự hợp nhất màng và giải phóng bộ gen của virus vào tế bào chất của vật chủ. (3-7) Các giai đoạn cho thấy các bước còn lại của quá trình nhân lên của virus, dẫn đến sự tập hợp virus, trưởng thành trong tế bào và giải phóng (nguồn trích dẫn [9]).
Cũng giống như các coronavirus khác, cơ chế lây bệnh của SC-2 thông qua các giọt bắn từ đường hô hấp bị nhiễm virus. Virus tiếp cận chủ yếu với các thụ thể đích trên các tế bào biểu mô đường hô hấp. Kết mạc, niêm mạc đường tiêu hóa cũng dễ bị nhiễm và có thể đóng vai trò như đường vào của virus. Khả năng lây nhiễm xảy ra chủ yếu do tiếp xúc gần (thí dụ như đối diện trong vòng 15 phút ở khoảng cách 2 m) và lây truyền đặc biệt hiệu quả trong không gian gia đình. Khả năng lây nhiễm trong nhà, trong môi trường kín cao hơn ở ngoài trời do các hạt bắn có chứa virus còn tồn tại trong môi trường lâu hơn [10-12]. Vai trò của lây nhiễm qua đường phân, tiếp xúc với các bề mặt cũng đã được xác định. Virus có thể tồn tại trong nhiều ngày trên các bề mặt trong điều kiện ẩm, nhiệt độ thấp và lây nhiễm tới mắt, mũi, miệng thông qua bàn tay. Tuy nhiên virus dễ dàng bị vô hiệu với các thuốc sát trùng và tẩy rửa. Lây truyền qua đường phân-miệng chưa được xác nhận [10].
Sau khi tiếp cận các thụ thể đích là ACE 2, virus nhân lên và giải phóng, gây nhiễm các tế bào phổi và tạo ra các triệu chứng hô hấp không đặc hiệu giống cúm. Virus cũng gây tổn thương các tế bào biểu mô khứu giác và làm mất khứu giác tạm thời. Sự phân bố các thủ thể ACE 2 ở các mô khác có thể giải thích vị trí nhiễm trùng ban đầu và triệu chứng trên bệnh nhân. Cũng có tác giả cho rằng đặc điểm trình diện thụ thể ACE là không khác nhau giữa các lứa tuổi, giới và chủng tộc. Điều này cho thấy khả năng nhiễm bệnh với mọi người là như nhau. Tuy nhiên cách đáp ứng miễn dịch của cơ thể chủ tạo ra sự khác biệt về mức độ bệnh giữa người này với người khác [13]. Một nghiên cứu trên trẻ em cho thấy viêm phổi do SC-2 không nặng hơn so với viêm phổi do các virus hô hấp khác [14].
Phản ứng viêm thu hút các lympho T đặc hiệu virus. Các tế bào miễn dịch này loại trừ các tế bào bị nhiễm, khống chế sự lan tràn của virus và trong đa số các trường hợp cơ thể bình phục [15]. Ở những trường hợp diễn biến nặng, đáp ứng miễn dịch theo hướng không hiệu quả [15,16]. Virus có khả năng tiếp cận các thụ thể ACE 2 trên các tạng khác như ruột, gan, tim, thận, nội mạc mạch máu, mạch bạch huyết. Bằng cách này, virus có thể tấn công nhiều tạng giống như đã thấy trong cúm và SC-1. Mạch máu và mao mạch phổi là vị trí bị tấn công chủ yếu do các tế bào nội mạc có mật độ cao thụ thể ACE2. Trên cơ sở này sẽ hình thành tổn thương viêm nội mạc mạch, thoát dịch do tăng tính thấm gây phù tổ chức và tạo huyết khối. Ở phổi, tổn thương ban đầu là phù và thâm nhập bạch cầu lympho TCD4, CD8. Ở thể nặng, cơn bão cytokine do tương tác của SC-2 với ACE2, làm tăng hoạt tính quá mức tế bào lympho T CD8, làm giảm hoạt tính tế bào lympho T CD4, giảm sản xuất các cytokine chống viêm và hoạt hóa bổ thể. Cuối cùng nhưng không kém phần quan trọng, viêm phổi nặng do SC-2 có liên quan đến tình trạng tăng đông máu toàn thân do tổn thương nội mạc mạch máu. Tiểu cầu được kích hoạt do tiếp xúc với nội mạc bị tổn thương, kích hoạt dòng thác đông máu do bão cytokine và giảm hoạt động của hệ thống tiêu sợi huyết [17]. Trong sinh bệnh học SC-2, vẫn còn nhiều câu hỏi chưa được giải đáp. Thay đổi cấu trúc, chức năng đường thở và nội mạc mạch, rối loạn chức năng cytokine, đông máu là các câu hỏi còn cần được nghiên cứu làm rõ [9]. Một minh chứng gần đây cho rằng dexamethasone làm giảm tỷ lệ tử vong ở những bệnh nhân thở máy bị viêm phổi nặng do SARS-CoV-2 cho thấy tầm quan trọng của việc cần làm sáng tỏ thêm các cơ chế sinh lý bệnh [17,18].
Khám nghiệm tử thi phổi trên những trường hợp tử vong đã xác nhận bản chất viêm của tổn thương với đặc điểm tổn thương phế nang lan tỏa và hình thành màng trong (hyaline), thâm nhiễm mô kẽ tế bào đơn nhân, bong vảy (desquamation), kiểu tổn thương ARDS cũng giống như đã thấy trong hội chứng hô hấp nặng Trung Đông (MERS) và SC-1 [19,20]. Hình ảnh viêm khác biệt trong SC-2 là có sự hiện diện của quá tiết, hình thành nút nhầy fibrin trong lòng đường thở. Đặc điểm này giải thích hiện tượng hô hấp nặng ngay cả đối với người trẻ mà nguyên nhân nhiều khả năng do quá tiết cytokine tiền viêm tích tụ trong phổi, thậm trí dẫn đến phá hủy nhu mô phổi [15]. Trên một số bệnh nhân, tăng tạo và tích tụ quá mức cytokine trong mô gây hội chứng thoát mạch, huyết khối, rối loạn chức năng tạng và hoại tử mô lan rộng [15,21] mà biểu hiện lâm sàng bằng diễn biến dẫn tới sốc, suy đa tạng. Hệ thống tim mạch thông thường bị tổn thương sớm biểu hiện bằng tăng troponin, natriuretic peptides. Biểu hiện tim mạch hợp nhất với bệnh cảnh rối loạn đông máu, xuất huyết phế nang, hình thành huyết khối tiểu cầu-fibrin trong các động mạch nhỏ [20].
Yếu tố cơ địa thể hiện qua tuổi, giới, bệnh lý nền cùng với tải lượng virus và khả năng miễn dịch đã có trước với coronavirus mùa là các yếu tố làm cho bệnh cảnh lâm sàng thay đổi. Mức độ tăng cytokine tiền viêm tương quan với mức độ nặng của tổn thương phổi và hình ảnh kính mờ trên CT ngực [21,22]. Trên bệnh nhân lâm sàng nặng, lượng cytokine tiền viêm và biomarker huyết thanh tăng cao hơn so với người lâm sàng nhẹ. Có bằng chứng cho thấy có tương quan giữa động học virus, mức độ nặng và kết cục bệnh [23]. Các nghiên cứu cho thấy trên bệnh nhân nặng có tăng tải lượng virus kéo dài kết hợp với tăng sớm interferon, cytokine, chemokine. Điều này cho thấy vai trò có ý nghĩa của tải lượng virus trong sinh bệnh học SC-2.
Hệ vi sinh (microbiota) trên đường hộ hấp có tác động như thế nào tới tiên lượng bệnh là câu hỏi được thực hiện bởi một nghiên cứu động học hệ vi sinh trên đường hô hấp trên trên bệnh nhân SC-2. Trong nghiên cứu này phân tích giải trình tự gen vi sinh bằng bệnh phẩm ngoáy họng cho thấy rối loạn thăng bằng hệ sinh thái vi sinh (dysbiosis) là biểu hiện rõ ràng kết hợp với tăng nồng độ cytokine tiền viêm và tử vong. Điều này cho thấy có sự tương tác bệnh lý giữa SC-2, tính cộng sinh (symbionts) của hệ vi sinh và tình trạng miễn dịch của cơ thể chủ. Nghiên cứu này lưu ý sự chuyển hướng microbiota làm gia tăng Streptococcus kết hợp với tiên lượng tốt hơn, ít bội nhiễm hơn và miocrobiota trên bệnh nhân tử vong dễ nhậy cảm với nhiễm trùng thứ phát hơn [24]. Trên bệnh nhân nặng nhập viện cần thở máy. Một nghiên cứu khác đã thực hiện nội soi trong 48 giờ sau đặt nội khí quản lấy bệnh phẩm và chẩn đoán vi trùng học cho thấy bội nhiễm vi khuẩn gặp trong 21% các trường hợp và chủ yếu là S.aureus và Streptococcus spp. [25]. Trong một nghiên cứu khác, xét nghiệm vi trùng học cũng được thực hiện ngay trong 48 giời đầu nhập viện trên bệnh nhân viêm phổi nặng SC-2 dương tính vào ICU cho thấy tỷ lệ đồng nhiễm với vi khuẩn là 28% và hầu hết liên quan đến Staphylococcus aureus, Haemophilus infuenzae, Streptococcus pneumoniae và Enterobacteriaceae [26].
Ngay từ những báo cáo đầu tiên suy hô hấp do SC-2, các ghi nhận đã cho thấy có hiện tượng không tương xứng giữa mức độ giảm oxy máu và cách thở nhẹ nhàng của bệnh nhân. Ghi nhận đầu tiên về hiện tượng này mô tả là “giảm oxy máu dễ chịu” hay “giảm oxy máu âm thầm” [27,28]. Tương tự, ngay sau khi đặt nội khí quản thở máy, mặc dù độ đàn hồi (compliance) phổi tốt nhưng vẫn có tình trạng giảm oxy máu nặng không giải thích được. Hiện tượng này được giải thích từ một nghiên cứu tử thiết phổi [29] cho thấy đa số bệnh nhân có tổn thương phổi dạng viêm tổ chức hóa (organising pneumonia, OP) với các thay đổi cấu trúc mô và xâm nhập fibrin (hình 2).
Hình 2. Hình trái: Hình ảnh vi thể cho thấy các nút collagen chưa trưởng thành hoặc các thể Masson (mũi tên) lấp đầy các khoảng khí. Có viêm kẽ mạn tính nhẹ. Hình phải: CT ngực bệnh nhân nữ 37 tuổi viêm phổi SC-2 cần thở oxy với FiO2 100% qua xông mũi lưu lượng cao trong
8 ngày. Vào ngày thứ 8, bắt đầu được điều trị với methylprednisolone 1000mg tiêm tĩnh mạch (tiêm nhắc lại – pulse-dose) trong 3 ngày, sau đó bệnh nhân có thể giảm đột ngột nhu cầu oxy và cuối cùng là thở khí phòng. (A) Hình ảnh CT cắt mỏng có cản quang 6 ngày sau khi bắt đầu có triệu chứng cho thấy hình ảnh GGO ngoại vi và quanh phế quản ở cả hai phổi điển hình của kiểu viêm phổi có tổ chức hóa. (B) Hình ảnh CT không cản quang 2 tuần sau khi xuất viện cho thấy xóa rõ dấu hiệu GGO với các ổ hợp nhất phổi nhỏ và vệt giãn phế quản (mũi tên) co kéo gợi ý xơ hóa nhẹ (ngườn trích dẫn [29])
Về đặc điểm mô bệnh học trong viêm phổi, mặc dù với rất nhiều tác nhân gây bệnh có khả năng gây tổn thương phổi, đặc điểm tổn thương có thể dưới 3 dạng: Tổn thương phế nang lan tỏa (diffuse alveolar damage, DAD), viêm phổi tổ chức hóa (organizing pneumonia, OP) hoặc viêm phổi tổ chức hóa có tăng fibrin cấp tính (acute fibrinous and organising pneumonia, AFOP), và viêm phổi tăng bạch cầu ái toan (eosinophilic pneumonia, EP). Viêm phổi tăng bạch cầu ái toan chưa được ghi nhận trong SC-2 [29].
Trong viêm phổi dạng DAD, tổn thương lan tỏa cả phế nang và cả trong lớp tế bào nội mạc mạch, như vậy dịch, protein có thể dễ dàng thoát vào lòng phế nang. Hai dạng phản ứng viêm ưu thế là tiết dịch/cấp tính và tổ chức hóa/tăng sinh tế bào. Dạng phản ứng đầu xảy ra ở pha sớm khi đó dịch tiết và protein thoát vào phế nang hình thành một màng hyaline lót thành phế nang và là nguyên nhân của hiện tượng phù phế nang không thể hấp thu. Dạng phản ứng sau đặc trưng bằng hiện tượng hấp thu dịch cùng với sự xâm nhập mô kẽ các nguyên bào sợi và sự lắng đọng sớm của collagen. Trên một số bệnh nhân, giai đoạn này tiến tới xơ hóa đặc trưng bằng xóa đi cấu trúc phổi.
Trong viêm phổi dạng tổ chức hóa (OP) và viêm phổi tổ chức hóa tăng fibrin cấp tính (AFOB) tổn thương lớp biểu mô lót thành phế nang gây thoát các protein đông tụ (coagulative), tích tụ fibrin do giảm hoạt tính tiêu sợi huyết. Trong OP, có sự hoạt hóa và tăng sinh nguyên bào sợi sau đó tạo ra một cấu trúc khung mô liên kết trong lòng phế nang và ống phế nang (hình 2). Trong AFOB, mặc dù cũng có hiện tượng “tổ chức hóa” tương tự nhưng trên hình ảnh mô học có sự xuất hiện ở mức độ cao các cuộn fibrin. Cũng như trong tổn thương dạng DAD, sau giai đoạn xuất tiết phù phế nang cấp tính là giai đoạn hấp thu và tăng sinh nguyên bào sợi trong mô kẽ. Protein, phù nề, fibrin hoặc các ổ tổ chức hóa của cả DAD, AFOP và OP có thể được hấp thu nhưng cũng có thể dẫn đến xơ phổi vĩnh viễn.
Hình thái mô học của AFOP ở bệnh nhân SC-2 đã được báo cáo trong một nghiên cứu phân tích tử thiết phổi [30]. Hình thái mô bệnh học trên bệnh nhân tử vong trong khoảng 20 ngày đầu kể từ khi có các triệu chứng là AFOP. Mặc dù AFOP đã được chẩn đoán nhưng trong nghiên cứu này số lượng mô không chắc chắn được kiểm tra đầy đủ, có thể đã bỏ sót sự hiện diện của màng hyalin vốn hỗ trợ chẩn đoán DAD. Một báo cáo khác trên khám nghiệm tử thi ở những bệnh nhân bị SC-2 nặng cũng cho thấy sự tích tụ fibrin đáng kể cùng với tổn thương vi mạch mà không có bằng chứng về màng hyalin xác định chẩn đoán DAD [31].
Một phân tích hệ thống gần đây về tất cả các phát hiện bệnh lý trong SC-2 cho thấy 59% mẫu bệnh phẩm có tổn thương vi mạch, AFOP hoặc cả hai, thường cùng tồn tại với tổn thương “biểu mô” (DAD) hoặc “xơ hóa” [32]. Do phân tích trên tử vong nên không thể nhận định được tổn thương ban đầu, ở giai đoạn sớm, trong 3 tuần kể từ khi có triệu chứng. Tuy nhiên, một nghiên cứu khám nghiệm tử thi trên bệnh nhân tử vong sớm trong vòng 14 ngày kể từ khi có triệu chứng (trong đó có 5 bệnh nhân tử vong trong 1 tuần kể từ khi có triệu chứng), các tác giả Bradley BT và cs. cho thấy hiện tượng tổ chức hóa đã xuất hiện sớm [33]. Điều này có thể lý được giải rằng giai đoạn tổn thương xuất tiết của DAD là giai đoạn tiền lâm sàng vì đã có báo cáo cho rằng trên những bệnh nhân trước khi có triệu chứng lâm sàng vẫn có thể phát hiện được bất thường trên CT ngực. Tuy nhiên, trong nghiên cứu của Shi H và cs. [34] hình ảnh CT phù hợp với OP mà không với DAD. Điều này gợi ý rằng OP có thể xuất hiện sớm, là tổn thương xuất hiện ban đầu và DAD xảy ra sau đó là hậu quả của tổn thương vi mạch, huyết khối, phản ứng tế bào và tổn thương phổi do thở máy. Tuy nhiên, cho đến hiện tại, chúng ta còn chưa thực sự kết luận được hình thái bệnh học tổn thương viêm phổi trong SC-2 như thế nào do thiếu bằng chứng về tổn thương sớm, mới chỉ có phân tích mô học trên những trường hợp nặng tử vong mà không có trên những trường hợp nhẹ, và phần lớn các trường hợp tử vong được phân tích đều đã qua thở máy kéo dài.
Trong một bài viết tổng quan với nhan đề “Viêm phổi tổ chức hoá do SARS COV-2: Phải chăng đã có sự bỏ qua phổ biến việc không xác định và điều trị tình trạng này trong dịch COVID 19 ?”, tác giả Pierre Kory và cs. cho rằng dựa trên các biểu hiện lâm sàng, các bất thường trên Xquang, các mẫu mô bệnh học trên khám nghiệm tử thi ít nhiều chồng lấp nhưng ủng hộ và kết hợp với các nghiên cứu báo cáo rằng bệnh nhân “đáp ứng với steroid”, viêm phổi do SC-2 ban đầu nên được hiểu là có phản ứng OP [29].
Tổn thương phổi do SC-2 tóm lại là vừa có tổn thương và lấp đầy phế nang vừa có thâm nhiễm mô kẽ với đúng nghĩa của ARDS: tình trạng suy hô hấp cấp tính, giảm oxy máu nghiêm trọng với thâm nhiễm phổi lan tỏa hai bên và không có rối loạn chức năng thất trái [1]. Như đã đề cập ở trên, tình trạng giảm oxy máu xảy ra trong trạng thái lâm sàng khá yên tĩnh, “thở dễ” và độ đàn hồi phổi còn duy trì tốt. Trong hầu hết các trường hợp, phân tích khí máu cho thấy có giảm oxy máu đồng thời với giảm CO2 (suy hô hấp type I). Tình trạng thở nhanh là do giảm oxy kích thích các hóa thụ thể và thụ thể J (thụ thể cảm nhận trên các mao mạch thành phế nang). Một yếu tố sinh bệnh học quan trọng khác cũng có tác động là sự thay đổi đường kính mạch máu phổi với tổn thương nội mạc lan tỏa, huyết khối làm thay đổi tương quan thông khí/tưới máu. Trong đó một số vùng phổi thông khí kém do tổn thương phế nang, phù kẽ trong khi một số vùng phổi khác được thông khí tốt nhưng tưới máu giảm do lòng mạch bị thu hẹp hay bít tắc. Tuy nhiên may mắn là ARDS chỉ xảy ra trên một số ít các trường hợp vì trên nhiều bệnh nhân vẫn còn các vùng phổi có thông khí, trao đổi khí và tưới máu tốt [1].
LÂM SÀNG
Lâm sàng hô hấp
Theo báo cáo của Đại diện WHO ở Trung Quốc, bệnh nhân nhiễm SC-2 bị sốt 87.9%, ho khan 67.7%, mệt mỏi 38.1%, tăng tiết đờm 33.4%, khó thở 18.6%, đau họng 13.9%, ớn lạnh 11.4%, nghẹt mũi 4.8% và ho máu 0.9% [35]. Một số bệnh nhân có thể nhanh chóng tiến triển thành viêm phổi cấp tính và ARDS với sốc nhiễm trùng. Khoảng thời gian trung bình từ khi xuất hiện các triệu chứng ban đầu đến khi phát triển khó thở, nhập viện và ARDS lần lượt là 5, 7 và 8 ngày [36]. Giảm oxy máu với độ bão hòa oxy có thể xuống 50 hoặc 60% nhưng tình trạng lâm sàng hô hấp vẫn khá ổn định [37,38]. Bất thường Xquang thường gặp nhất trong số bệnh nhân mắc SC-2 khi chụp cắt lớp vi tính (CT) ngực là hình ảnh kính mờ 56.4% và mờ hai bên 51.8% [39]. Bất thường trên CT ngực phổ biến tiếp theo sau hình ảnh kính mờ là động đặc nhưng hình ảnh tổn thương trên CT khác nhau giữa các bệnh nhân giữa các thời điểm chẩn đoán. Các tổn thương khác có thể gặp là dầy vách liên tiểu thùy, hình ảnh mờ dạng lưới, hình ảnh khảm, v.v. Những hình ảnh không điển hình như hình phế quản hơi, tràn dịch màng phổi, dầy thành phế quản, mờ dạng nốt và hạch cũng đã có một số nghiên cứu thông báo [40]. Một nghiên cứu trên 877 bệnh nhân không nặng và 173 bệnh nhân nặng không thấy có bất thường trên Xquang ngực lần lượt là 17.9 và 2.9% [39].
Lâm sàng các cơ quan ngoài phổi
Triệu chứng tai-mũi-họng: Là biểu hiện thường gặp nhất trong bệnh cảnh nhiễm SC-2. Triệu chứng lâm sàng đặc biệt gồm giảm khứu giác, vị giác. Các triệu chứng này có trên khoảng 50% các trường hợp và thường có ở giai đoạn sớm [41]. Các triệu chứng TMH khác có thể thấy như đau họng, nghẹt mũi-chảy nước mũi, sưng hạch bạch huyết vùng họng.
Triệu chứng hệ thống tim-mạch: Biểu hiện tim ở bệnh nhân nhiễm SC-2 có thể do căng cơ tim gián tiếp do thiếu oxy và suy hô hấp. Tác động trên tim cũng có thể trực tiếp do viêm cơ tim, bão cytokine, rối loạn chuyển hóa, vỡ mảng bám, tắc mạch vành do huyết khối. Các biểu hiện tim gặp cao hơn trên những bệnh nhân nặng, cần thở máy. Trên những bệnh nhân này thông thường có thay đổi trên ECG cũng như có tăng troponin và NT proBNP. Đã có các báo cáo về tăng huyết áp, viêm cơ tim cấp và tối cấp, hội chứng vành cấp ST chênh lên, nhồi máu cơ tim [42-44], loạn nhịp. Các triệu chứng cơ năng tim ít gặp hơn là cơn đau thắt ngực, hồi hộp. Sau khi hết bệnh, một số bệnh nhân vẫn còn loạn nhịp do di chứng sẹo trên cơ tim. Một điểm quan trọng cần lưu ý là sử dụng thuốc tác động điều biến trên hệ thống Renin Angiotensin Aldosterone. Các tổ chức tim mạch Mỹ (ACC/ AHA / HFSA) khuyến cáo tiếp tục sử dụng các thuốc này trên những bệnh nhân có nguy cơ cao do đã có bằng chứng việc sử dụng thuốc ức chế và phong tỏa ACE (ACEi/ARB) làm giảm tử vong và diễn biến nặng so với không sử dụng [45,46].
Triệu chứng hệ tiêu hóa: Triệu chứng tiêu hóa có thể có do tác động của SC-2 trên các thụ thể ACE trên niêm mạc ruột hoặc do tổn thương gan trong bệnh cảnh viêm toàn thân và suy đa tạng. Triệu chứng tiêu hóa có thể là đơn độc hoặc có thể sớm trước khi có biểu hiện triệu chứng hô hấp. Trên bệnh nhân có thể thấy không thèm ăn, đau bụng, tiêu chảy, tiêu phân máu, buồn nôn và nôn [47-49].
Triệu chứng thận: Triệu chứng tổn thương thận có thể trực tiếp do CS-2 xâm nhập vào các tế bào cầu thận hay tế bào ống lượn gần. Tổn thương thận cũng có thể gián tiếp thông qua tình trạng giảm oxy, bão cytokine, nhiễm trùng, tiêu cơ vân và sử dụng các thuốc độc thận. Tổn thương thận có thể gặp trên bệnh nhân nhập viện, giao động từ 0.5-29% [18]. Lâm sàng có thể thấy protein niệu, tiểu máu, tăng ure/creatinine, giảm độ lọc cầu thận. Tổn thương thận thường kết hợp với bệnh nhân thở máy và suy thận làm tăng tử vong trên bệnh nhân nhập viện [50].
Triệu chứng hệ thần kinh: Virus SC-2 có thể tấn công thần kinh trung ương, tới các tế bào thần kinh, tế bào thần kinh đệm từ đường máu hay ngược dòng từ đường thần kinh khứu giác. Bệnh cảnh viêm toàn thân, thiếu oxy, rối loạn chức năng đông máu cũng có thể làm chết tế bào thần kinh. Trên hầu hết bệnh nhân có triệu chứng thần kinh, triệu chứng có xu hướng xuất hiện sớm, cùng với triệu chứng hô hấp. Các biểu hiện có thể là đau đầu, lú lẫn, co giật, mê sảng. Trên bệnh nhân nhập viện, mặc dù có điều trị dự phòng thuyên tắc huyết khối tĩnh mạch, tỷ lệ đột quỵ do thiếu máu cục bộ gặp trong khoảng 2.5-5% [18]. Các trường hợp viêm não, màng não, viêm đa dây thần kinh cũng đã được ghi nhận [51-54].
Triệu chứng mắt: Không có ghi nhận triệu chứng tổn thương mắt nặng. Biểu hiện thông thường là viêm kết mạc xung huyết, chảy nước mắt.
Triệu chứng hệ cơ-xương-khớp: Triệu chứng đau, nhức mỏi cơ là triệu chứng có sớm [55]. Trên những bệnh nhân nặng suy đa tạng, đã có báo cáo tình trạng viêm, tiêu cơ vân với biểu hiện tăng cao creatinine kinase và viêm khớp cấp tính [56,57].
Triệu chứng huyết học: Bệnh cảnh bệnh do SC-2 là viêm và nhiễm trùng toàn thân và trong một số trường hợp đi kèm tình trạng bão cytokine nên có tác động không nhỏ tới cơ chế đông máu và tạo máu. Trong giai đoạn đầu bạch cầu máu và bạch cầu lympho có thể bình thường hoặc giảm. Bạch cầu lympho, tiểu cầu máu giảm rõ rệt trong bệnh cảnh bão cytokine và nặng [39]. Giảm bạch cầu máu kết hợp với tăng nguy cơ nhập ICU và ARDS. Trong bệnh cảnh SC-2, tăng bạch cầu có thể liên quan tới tình trạng bội nhiễm khuẩn. Tăng tiểu cầu, tăng tỷ lệ tiểu cầu/bạch cầu lympho có thể là dấu chứng của bão cytokine [58]. Rối loạn đông máu biểu hiện bằng giảm tiểu cầu, thời gian PT kéo dài, giảm fibrinogen, tăng D-dimer. Các triệu chứng của đông máu nội mạch lan tỏa (DIC) thấy rõ trên những trường hợp nặng [59]. Interleukin-6 (IL-6) tăng cao trên bệnh nhân nặng và diễn biến của IL-6 là marker quan trọng tiên lượng diễn biến xấu gắn liền với tình trạng tăng viêm và bão cytokine [60].
Đánh giá trên những trường hợp đã có chấn đoán vi sinh xác định SC-2 cho thấy sự hiện diện của khó thở, tăng nhịp thở >30 lần/phút, SaO2 ≤93%, PaO2/FiO2≤300, thâm nhiễm phổi 2 bên ≥50% diện tích trong 12-48 giờ kết hợp có ý nghĩa với tăng diễn biến nặng [35]. Các triệu chứng lâm sàng suy hô hấp, sốc nhiễm trùng, suy đa tạng là tình trạng nặng và tiên lượng xấu. Các bệnh lý nền (tiểu đường, bệnh tim mạch, ung thư, bệnh hô hấp mạn tính) và tuổi trên 80 làm tăng nguy cơ nặng và tử vong [35]. Một nghiên cứu ở Tây Ban Nha cho thấy khó thở là yếu tố tiên lượng nặng, giảm tri giác là yếu tố tiên lượng tử vong và ho là yếu tố tiên lượng tốt [61]. Tăng bạch cầu ái toan là marker tiên lượng tốt [61]. Tỷ lệ tử vong thấp hơn ở những bệnh nhân có các triệu chứng tiêu chảy, đau cơ khớp, nhức đầu, mất khứu giác và vị giác trong khi bão hòa oxy máu thấp, tăng cao CRP và tổn thương rộng trên Xquang ngực có liên quan đến bệnh nặng và tử vong [61]. Hơn một nửa số bệnh nhân bị viêm phổi SC-2 có biểu hiện bất thường về chức năng phổi sau 30 ngày khởi phát triệu chứng mặc dù không có mối liên hệ rõ ràng với tăng mức độ viêm phổi trên CT ngực. Điều này cho thấy cần theo dõi có hệ thống và lâu dài bệnh nhân bị viêm phổi SC-2 [62].
HÌNH ẢNH XQUANG THƯỜNG QUY VÀ CT SCAN NGỰC
Hệ thống hô hấp là cơ quan đầu tiên bị SC-2 lây nhiễm vì vậy trên những trường hợp nghi ngờ, thông thường yêu cầu chụp Xquang ngực được thực hiện đầu tiên. Tuy nhiên, hiệu suất chẩn đoán của Xquang ngực trong ở giai đoạn đầu của bệnh là hạn chế và đã có báo cáo rằng các phát hiện bệnh lý đã có thể xác định được trên chụp cắt lớp vi tính lồng ngực (CT) nhưng không thấy trên Xquang ngực thường quy [63-65] (hình 3). Có thể phát hiện được tổn thương trên CT ngay cả khi chưa có triệu chứng lâm sàng và có thể cả khi xét nghiệm RT-PCR còn (-) [63,66,67]. Điều này cho thấy giá trị thực hành của CT trong viêm phổi do SC-2.
Theo một số nghiên cứu, tổn thương dạng kính mờ (ground-glass opacitie, GGO) đơn thuần hoặc kết hợp với mờ dạng đông đặc (consolidation) là dạng tổn thương phổ biến nhất trong viêm phổi do SC-2. Các hình ảnh bất thường khác bao gồm dầy vách liên tiểu thùy, dãn phế quản, dầy màng phổi, hình ảnh mờ dạng khảm (crazy-paving pattern) thường có cả hai bên với ưu thế ở thùy dưới và phía sau (hình 4).
Hình 3. (A) Hình ảnh Xquang ngực. (B) Hình CT ngực tái tạo trước-sau. Bệnh nhân dương tính với SC-2. Mờ dạng GGO được xác định dễ dàng hơn trên hình ảnh CT ngực so với phim Xquang ngực (nguồn trích dẫn: Sánchez-Oro R, Torres Nuez J, Martínez-Sanz G. La radiología en el diagnóstico de la neumonía por SARS-CoV-2 (COVID-19). Med Clin (Barc). 2020;155:36–40).
Hình 4. Hình A: Hình CT ngực bệnh nhân 60 tuổi SARS-CoV-2 dương tính. Hình mờ GGO ở ngoại vi được quan sát thấy ở cả haI đáy phổi (mũi tên đứt nét), đông đặc ở phân thùy lưỡi (mũi tên đen) và giãn phế quản (mũi tên trắng). Hình B: Hình CT ngực bệnh nhân 60 tuổi SARS-CoV-
2 dương tính . Có hình mờ dạng khảm (hộp đen) tạo nên do các vết mờ của GGO nền chồng lên nhau kết hợp với sự dày lên của vách liên tiểu thùy phổi. (nguồn trích dẫn: Sánchez-Oro R, Torres Nuez J, Martínez-Sanz G. La radiología en el diagnóstico de la neumonía por SARS-CoV-2 (COVID-19). Med Clin (Barc). 2020;155:36–40).
Theo Salehi và cs nhận xét trên 919 bệnh nhân đã có xác nhận nhiễm SC-2 đặc điểm tổn thương thường thấy nhất trên CCT là GGO 88.0%, tổn thương hai bên 87.5%, phân bố ngoại vi 76.0% và tổn thương nhiều hơn một thùy phổi 78.8% [63]. Các tổn thương khác khác ít phổ biến hơn như tràn dịch màng phổi, tràn dịch màng ngoài tim, sưng hạch trung thất, tràn khí màng phổi.
Các tổn thương phổi đã có trên CT từ rất sớm, có thể có ngay cả trước khi có các triệu chứng lâm sàng. Jin và cs. phân loại bệnh nhân mắc tổn thương trên CT thành 5 giai đoạn theo thời gian tiến triển: rất sớm, sớm, tiến triển nhanh chóng, hợp nhất và tiêu tan [68].
Giai đoạn đầu tiên hoặc giai đoạn rất sớm, trong tuần đầu tiên và tuần thứ hai sau khi tiếp xúc, bệnh nhân không có triệu chứng, kết quả CT chụp phổ biến nhất là một hoặc nhiều vùng mờ dạng GGO, đông đặc, nốt kết hợp với hình ảnh phế quản hơi. Giai đoạn 2, hay giai đoạn bắt đầu có các triệu chứng lâm sàng có biều hiện bất thường trên CT trên đa số các trường hợp (54%). Biểu hiện bằng hình ảnh đa dạng GGO kết hợp với hình dày vách liên tiểu thùy tạo ra hình ảnh tổn thương dạng khảm. Giai đoạn 3, giai đoạn tiến triển nhanh sau 3-7 ngày sau khi có triệu chứng lâm sàng. Biểu hiện bằng tổn thương đông đặc rộng kết hợp hình phế quản hơi. Giai đoạn 4 tương ứng với khoảng thời gian 2 tuần sau khi có triệu chứng. Hình ảnh mờ đông đặc phổi giảm dần mật độ và diện tích. Giai đoạn 5, giai đoạn sau 2-3 tuần từ khi có triệu chứng. Hình ảnh mờ ở phổi đậm hơn kết hợp với hình dầy thành phế quản, vách liên tiểu thùy tạo ra hình ảnh mờ dạng lưới [64]. Với ghi nhận như trên, chúng ta có thể hình dung tổn thương ban đầu có vẻ xuất phát từ mô kẽ, lan vào phế nang và tới phế quản. Điều này cũng phù hợp với triệu chứng lâm sàng giảm oxy máu có thể nặng nhưng không tạo ra triệu chứng lâm sàng hô hấp rầm rộ như đã mô tả là “giảm oxy máu dễ chịu” ở trên. Hình ảnh dầy vách phế quản, vách phế nang và hình ảnh lưới ở giai đoạn sau phản ánh tình trạng tăng sinh xơ trong tổn thương. Đây là tổn thương có thể giải thích di chứng giảm chức năng thở của bệnh nhân còn duy trì kéo dài sau khi đã xóa hết tổn hình ảnh mờ trên phim [63,65,69]. Tổn thương dạng lưới này có thể thấy trên Xquang ngực thường quy (hình 5).
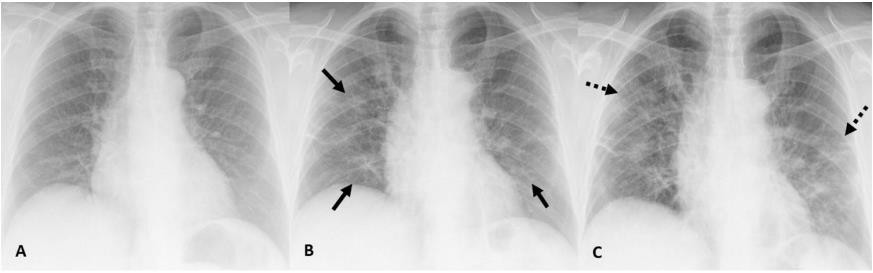
Hình 5. (A) Hình ảnh chụp X-quang ngực của bệnh nhân 75 tuổi đến khoa cấp cứu, có bệnh sử 1 ngày với các triệu chứng tương thích với nhiễm SC-2 nhưng không có bất thường Xquang ban đầu mặc dù kết quả PCR dương tính với SARS -CoV-2. (B) Hình ảnh Xquang ngực 4 ngày sau, trong đó GGO hai bên được xác định rõ. (C) Hình ảnh Xquang ngực 2 ngày sau đó cho thấy mờ dạng lưới do dày vách liên tiểu thùy với sự có mặt của mờ dạng GGO. (nguồn trích dẫn: Sánchez- Oro R, Torres Nuez J, Martínez-Sanz G. La radiología en el diagnóstico de la neumonía por SARS-CoV-2 (COVID-19). Med Clin (Barc). 2020;155:36–40).
Hình ảnh bất thường thông thường xuất hiện rõ trên CT vào khoảng ngày thứ 10 và sau ngày 14, 25% bệnh nhân tổn thương xóa dần [63,70]. Trên những bệnh nhân diễn biến xấu, hình ảnh tổn thương có khuynh hướng phát triển, giống như hình ảnh ARDS thấy trên cả Xquang ngực thường quy và CT. Trên bệnh nhân nhập ICU, hình ảnh tổn thương được mô tả thông thường là tổn thương dạng đông đặc rộng có thể có tràn dịch màng phổi mà nguyên nhân có thể do suy tim trong bệnh cảnh ARDS [63,71].
Hình ảnh tổn thương trên CT ngực không khác nhau giữa bệnh nhân có triệu chứng và không triệu chứng, bệnh nhân có sốt hay không sốt [72]. Trên thai phụ, tiến triển có vẻ không đưa đến tình trạng nặng hay xơ hóa. Trên thai phụ, tất cả bệnh nhân đều cải thiện tốt và không có biến chứng cho em bé mới sinh [73]. Tổn thương dạng GGO gặp nhiều hơn trên người trẻ (<50 tuổi) trong khi tổn thương dạng động đặc gặp nhiều hơn trên người lớn tuổi (≥50 tuổi) và nhóm tuổi này cũng gặp các dạng tổn thương điển hình nhiều hơn [68,74]. Tổn thương dạng GGO có thế thấy cả khi test RT-PCR SC-2 âm tính [66,67]. Trên những bệnh nhân test RT-PCR (-) thường tổn thương không lan tới ngoại vi, tổn thương ít rộng hơn.
Với những trường hợp test (+), hay gặp hình ảnh phế quản hơi và mờ dạng lưới hơn [75]. So với các viêm phổi do các virus hô hấp khác, hình ảnh tổn thương phổi SC-2 không có sự khác biệt rõ và do vậy, với một hình ảnh tổn thương nghi ngờ, cần xét nghiệm chẩn đoán virus học để xác định căn nguyên [63,76].
CHẨN ĐOÁN
Bệnh khởi phát cấp tính. Giai đoạn ủ bệnh kéo dài khoảng 2-6 ngày, tối đa là 16 ngày. Thời gian ủ bệnh cơ bản không khác biệt với virus hô hấp hay coronavirus khác [4].
Khi có triệu chứng lâm sàng, bệnh nhân có triệu chứng nhiễm virus hô hấp kinh điển như đau nhức mình, mệt mỏi, sốt, ho, đau họng, chảy nước mũi, viêm kết mạc. Xét nghiệm bạch cầu máu bình thường hoặc giảm và Xquang hay CT ngực ngực có tổn thương. Bệnh nhân thường có tiền sử vừa đi du lịch hay đi qua vùng dịch tễ. Các diễn biến hô hấp nặng thường xuất hiện sau tuần đầu kể từ khi có triệu chứng và các biến chứng tổn thương đa cơ quan gặp sau đó khoảng vào tuần thử 2 (hình 6). Khởi đầu triệu chứng có thể không tập trung vào cơ quan hô hấp nên dễ dẫn tới chẩn đoán bệnh lý ở các cơ quan khác như triệu chứng tiêu hóa, triệu chứng thần kinh như đã mô tả ở trên. Bất luận tình trạng lâm sàng như thế nào cũng cần kiểm tra tình trạng oxy máu và xử trí giảm oxy máu là cấp thiết trước khi thực hiện các xét nghiệm tiếp theo để chẩn đoán.
Các xét nghiệm để xác định đã có tác động gây tổn thương tới các cơ quan khác hay chưa, biểu hiện bằng các bất thường của các cơ quan đích mà SC-2 tấn công như gan, thận, tim mạch, máu... cần được thực hiện khi tiếp cận lần đầu trên bệnh nhân nhập viện. Tiêu chuẩn chẩn đoán gồm yếu tố dịch tễ, biểu hiện lâm sàng, xét nghiệm virus học dịch tiết đường thở bằng test rRT-PCR (real-time reverse-transcriptase–polymerase-chain reaction) và hình ảnh bất thường trên Xquang ngực hay CT ngực. Những trường hợp nghi ngờ, có sốt nhưng bạch cầu máu không tăng cần xác định thêm chẩn đoán bằng CT ngực sớm khi có điều kiện nếu xét nghiệm virus (-).
Hình 6. Sự xuất hiện của các triệu chứng của COVID-19 theo ngày. (Nguồn trích dẫn [4])
ĐIỀU TRỊ
Tất cả các trường hợp có nghi ngờ có chỉ định sàng lọc chẩn đoán đều phải cách ly y tế tại chỗ và khi được chẩn đoán, nên được chuyển đến một cơ sở điều trị đã được chỉ định trước [76].
Điều trị bệnh nhân cần thực hiện với 2 nguyên tắc là cách ly và theo mức độ nặng. Một trường hợp cần được xem là nặng và cần được nhập viện sớm nhất có thể khi nhịp thở trên 30 lần/phút hoặc có cảm giác khó thở, SaO2 ≤ 95% thở khí phòng (hoặc PaO2/FiO2 <300), hình ảnh Xquang ngực hay CT tổn thương rộng, đa thùy hoặc tiến triển nhanh tăng trên 50% trong vòng 48 giờ, qSOFA (quick sequential organ failure assessment) ≥ 2, CURB-65 ≥ 1, có tràn khí màng phổi, có tình trạng bệnh khác cần nhập viện [77]. Khi có chẩn đoán suy hô hấp, suy đa tạng, sốc nhiễm trùng, cần nhập ngay ICU [77].
Điều trị chung
Bệnh nhân cần được nghỉ ngơi hay nằm tại giường tùy theo mức độ nặng và được theo dõi chặt chẽ các dấu hiệu sinh tồn quan trọng và mức độ bão hòa oxy. Cần đảm bảo điều trị bằng thuốc bổ trợ, bao gồm cung cấp năng lượng và nước- điện giải, cân bằng nội môi và thăng bằng kiềm – toan.
Oxy trị liệu
Bệnh nhân giảm oxy máu cần được cho thở oxy ngay và duy trì bão hòa oxy máu không dưới 90% ở nam giới và phụ nữ không mang thai, và từ 92% đến 95% ở phụ nữ có thai.
Bệnh nhân giảm oxy máu nhẹ nên được đặt ống xông mũi, 5 L/phút. Nếu bệnh nhân không đáp ứng tốt, sử ống xông mũi lưu lượng cao (high-flow nasal cannula) với 20 L/phút và tăng dần lên 50–60 L/phút. FiO2 điều chỉnh theo SaO2. Thở máy không xâm lấn cần xem xét cho bệnh nhân có thể dung nạp. Thở máy xâm lấn với nội khí quản cần thực hiện ngay khi có chỉ định như cho 1 trường hợp ARDS. Những trường hợp ARDS nặng, hồi sức hô hấp ở tư thế nằm sấp hoặc oxy hóa máu bằng kỹ thuật ECMO.
Các thuốc điều trị hướng tới kháng SC-2
Kinh nghiệm từ các dịch SARS và MERS đã cho những hiểu biết có giá trị về liệu pháp dược lý tiềm năng trong đại dịch SC‐2. Một số thuốc có hoạt tính in vitro và in vivo rõ ràng chống lại SARS‐CoV và MERS‐CoV đã được đề xuất như là ứng cử viên tiềm năng cho điều trị SC‐2 mặc dù lợi ích lâm sàng còn chưa được chứng minh. Vòng đời của virus có thể là mục tiêu tiềm năng cho các loại thuốc kháng vi rút: Sự xâm nhập vào tế bào vật chủ, sản xuất polyprotein và nhân lên. Chloroquine (CQ) và hydroxychloroquine (HCQ) được sử dụng để điều trị và ngăn ngừa bệnh sốt rét, các bệnh viêm mạn tính, có khả năng ngăn chặn sự xâm nhập của virus SC-2 vào tế bào chủ bằng cách ức chế quá trình glycosyl hóa của các thụ thể vật chủ, quá trình phân giải protein và axit hóa nội bào. Hơn nữa, tác dụng điều hòa miễn dịch cũng đã được mô tả cho cả hai loại thuốc này nhờ vào việc giảm sản xuất cytokine và ức chế hoạt tính tự hủy (autophagy) và lysosome trong tế bào vật chủ [78-84]. Mặc dù không có bằng chứng lâm sàng chứng minh hiệu quả của trị liệu CQ và HCQ nhưng nghiên cứu trên in vitro đã chứng minh cả hai thuốc này đều làm giảm sự nhân lên của virus SC‐2 theo cách phụ thuộc nồng độ [85]. Một số nghiên cứu quan sát hồi cứu đánh giá hiệu quả lâm sàng của CQ hoặc HCQ đối với SC‐2 cũng đã được tiến hành nhưng với kết quả còn gây tranh cãi [1]. Nhiều nghiên cứu về sau trên mẫu lớn cũng không chứng minh được hiệu quả lâm sàng của thuốc mà bên cạnh đó còn làm dấy lên quan ngại về độc tính của thuốc khi điều trị [86-89].
Lopinavir / ritonavir (LPV / r) là dạng thuốc kết hợp đã được phê duyệt trong điều trị HIV. LPV là chất ức chế protease và ritonavir là chất tăng cường LPV bằng cách ức chế cytochrome P450. Các nghiên cứu trên in vitro đã chứng minh hoạt tính kháng SARS-CoV và MERS-CoV của LPV thông qua khả năng ức chế 3‐chymotrypsin – chất giống protease [90-93]. Choy và cs. đã báo cáo tác dụng kháng SC‐2 của LPV nhưng không phải của ritonavir trên in vitro [94]. Có một số nghiên cứu lâm sàng liên quan đến hoạt động của LPV / r chống lại coronavirus ở người, chủ yếu được tiến hành trên nhiễm SC-1, với kết quả hứa hẹn [91,95]. Một nghiên cứu đã chứng minh rằng sự kết hợp LPV / r và ribavirin có tác dụng hiệp đồng hiệu quả đối với việc điều trị SARS trong giai đoạn đầu của nhiễm trùng [95]. Các báo cáo liên quan đến hoạt động của LPV / r chống lại SC‐2 chủ yếu xuất phát từ các báo cáo ca bệnh hoặc các nghiên cứu hồi cứu nhỏ, không phân nhóm ngẫu nhiên, với các kết quả còn gây tranh cãi. Do đó, các kết quả này không cho phép khẳng định hiệu quả trực tiếp của LPV / r đối với SC‐2 [96]. Gần đây, CB Wang và cs. đã đánh giá hiệu quả của LPV / r so với trị liệu chuẩn ở 199 bệnh nhân nhập viện vì SC-2 nặng, không có sự khác biệt đáng kể về thời gian cải thiện lâm sàng hoặc về tỷ lệ tử vong trong 28 ngày hoặc về độ thanh thải virus. Tuy nhiên, LPV / r đã được chỉ định sử dụng muộn sau khi nhiễm SC‐2, trung bình là 13 ngày kể từ khi bắt đầu có triệu chứng [97]. Khi phân tích dưới nhóm trong nghiên cứu trên những bệnh nhân bắt đầu LPV / r trong vòng 12 ngày kể từ khi khởi phát triệu chứng cũng không tìm thấy sự khác biệt đáng kể nào về cải thiện lâm sàng [97]. Do đó, thời điểm sử dụng thuốc kháng virus có vẻ rất quan trọng. Việc bắt đầu LPV / r sau giai đoạn nhân lên, khi tải lượng virus đã đạt đỉnh (7–10 ngày đầu), không làm thay đổi kết quả lâm sàng [95,96]. Các thử nghiệm lâm sàng RCT khác đang đánh giá vai trò của LPV / r trong nhiễm SC‐2. Ví dụ, thử nghiệm Discovery, một thử nghiệm lâm sàng mở ngẫu nhiên, đa trung tâm, có hiệu chỉnh sai số (adaptive), nhằm đánh giá hiệu quả lâm sàng và tính an toàn của 4 nhóm điều trị: remdesivir, LPV / r, Interferon ‐ beta 1A, HCQ ngoài điều trị tiêu chuẩn thường quy [89]. Thử nghiệm Recovery của Đại học Oxford ở Anh gần đây đã mô tả không có lợi ích lâm sàng nào từ việc sử dụng LPV / r ở bệnh nhân nhập viện với SC-2 cũng như không có sự khác biệt có ý nghĩa trong việc làm giảm nguy cơ tiến triển đến thở máy hoặc thời gian nằm viện [88]. Tuy nhiên, những kết quả này có thể không được áp dụng cho những bệnh SC-2 nặng cần thông khí xâm lấn vì không thể có nghiên cứu trên một số lượng đủ lớn bệnh nhân thở máy.
Các thuốc ức chế protease khác có khả năng kháng SC-2 như darunavir/cobicistat (DRV/c) hoặc /ritonavir nhờ cơ chế hoạt động giống như của LPV. Các nghiên cứu thực nghiệm trên tế bào in vitro đã chứng minh hoạt động đáng kể của DRV / c chống lại SC‐2 [98]. Tuy nhiên, có rất ít dữ liệu về hiệu quả và tính an toàn của DRV / c chống lại SC-2 [1]. Remdesivir, có tên chính thức là GS ‐ 5734, là một chất tương tự nucleotide, một tiền chất bắt chước adenosine và gây ra sự kết thúc sớm quá trình sao chép RNA của virus bằng cách ức chế RNA polymerase phụ thuộc RNA của virus. Thuốc vốn được phát triển ban đầu để chống lại sự lây nhiễm của virus Ebola. Remdesivir đã cho thấy có phổ kháng virus rộng chống lại các virus RNA khác nhau, chẳng hạn như họ coronaviridae và họ flaviviridae. Hoạt tính mạnh của thuốc trên in vitro và trong tế bào người chống lại MERS ‐ CoV và SARS ‐ CoV đã được chứng minh [99]. Các kết quả gần đây từ các nghiên cứu in vitro và in vivo đã chỉ ra rằng remdesivir có hoạt tính kháng virus mạnh đối với SC‐2 [100-102]. Trong một một nghiên cứu lâm sàng loạt ca đa trung tâm, đa quốc gia, 53 bệnh nhân SC‐ 2 nặng đã được nhận thuốc thuốc điều trị trên cơ sở cung cấp từ thiện trong tối đa 10 ngày cho thấy 68% trong số họ (36/53) có cải thiện lâm sàng và trong số 30 bệnh nhân được thở máy tại thời điểm ban đầu có 17 (57%) được rút nội khí quản [103]. Một thử nghiệm lâm sàng đa trung tâm RCT so sánh với giả dược đã chọn ngẫu nhiên 236 bệnh nhân có SC-2 mức độ nặng trung bình theo tỷ lệ 2:1 hoặc với remdesivir (200 mg ngày đầu tiên và sau đó 100 mg trong 9 ngày) hoặc giả dược đã không cho thấy sự khác biệt đáng kể giữa hai nhóm về thời gian cải thiện lâm sàng cũng như tỷ lệ tử vong trong 28 ngày [104]. Tuy nhiên, remdesivir có liên quan đến thời gian cải thiện lâm sàng nhanh hơn ở những bệnh nhân được điều trị trong vòng 10 ngày kể từ khi khởi phát của các triệu chứng, mặc dù không có ý nghĩa thống kê. Hơn nữa, trong nghiên cứu này, remdesivir không làm giảm đáng kể tải lượng RNA SC-2 ở đường hô hấp trên mặc dù thuốc có tác dụng kháng virus mạnh trong các mô hình nghiên cứu tiền lâm sàng [104]. Cuối cùng, báo cáo kết quả sơ bộ từ một thử nghiệm lâm sàng mù đôi, ngẫu nhiên, có đối chứng với giả dược đã được công bố gần đây cho thấy tác dụng đáng khích lệ của remdesivir ở người lớn nhập viện bị nhiễm SC-2 đường hô hấp dưới [105]. Trong tổng số 1059 bệnh nhân, 538 người được chỉ định dùng remdesivir và 521 người dùng giả dược. Nhóm sử dụng thuốc cho thấy thời gian hồi phục trung bình ngắn hơn (11 so với 15 ngày, p <0,001) và tỷ lệ tử vong thấp hơn ở ngày14 (7,1 so với 11,9%). Vào ngày 1 tháng 5 năm 2020, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt khẩn cấp remdesivir cho điều trị bệnh nhân nhập viện với nghi ngờ hoặc xác nhận SC-2 nặng [106]. Như vậy, do đặc tính của thuốc, remdesivir là ứng cử viên tốt nhất để điều trị SC‐2.
Một số thử nghiệm ngẫu nhiên khác đang được tiến hành để đánh giá hiệu quả của remdesivir chống lại nhiễm trùng SC‐2. Mặc dù nhiều nghiên cứu đã được tiến hành, nhưng kết quả gây tranh cãi từ các kết quả nghiên cứu chưa chứng minh rõ ràng được hiệu quả của những thuốc đối với SC‐ 2 [1] (18). Hiện tại không có bằng chứng chất lượng cao để ủng hộ bất kỳ phương pháp điều trị nào hiện đang được đề xuất để cải thiện kết quả lâm sàng. Các tổ chức, hiệp hội khoa học lớn (WHO; IDSA; CDC; NIH) khuyến cáo rằng bệnh nhân nên được điều trị trong bối cảnh thử nghiệm lâm sàng chính thức [107,108]. Các nghiên cứu lâm sàng RCT cần thiết tiếp tục để xác định tính an toàn, hiệu quả, tác hại và lợi ích của các thuốc chống lại sự lây nhiễm SC‐2. Theo khuyến cáo của Trung Quốc [76] thì thuốc kháng virus hiện chưa có bằng chứng ủng hộ trong điều trị SC-2 nhưng có thể sử dụng Lopinavir/ritonavir. Còn ở Mỹ (Johns Hopkins University /The Johns Hopkins Hospital) remdesivir được khuyến cáo sử dụng [109].
Các điều trị hỗ trợ
Do thiếu bằng chứng về thuốc kháng virus, phương pháp điều trị chính của SC-2 vẫn là các trị liệu hỗ trợ, bao gồm một số biện pháp can thiệp từ thuốc để giảm triệu chứng đến liệu pháp oxy và chăm sóc đặc biệt. Tuy nhiên, các liệu pháp bổ trợ, chẳng hạn như corticosteroid và các chất điều hòa miễn dịch, đang ngày càng được quan tâm, đặc biệt là trong giai đoạn (phase) thứ hai của nhiễm trùng. Trong giai đoạn cơn bão cytokine, các thông số viêm tăng cao, bao gồm CRP và các cytokine tiền viêm (IL-6, TNF-α, IL-8, v.v.), có thể xảy ra, và có thể xảy ra viêm mạch, tăng đông máu và tổn thương nhiều cơ quan. Diễn biến bệnh lý này cho thấy sẽ là hợp lý để cố gắng ngăn chặn cơn bão cytokine. Các marker sinh học như chỉ số PaO2 / FiO2 <250 mmHg, CRP, IL‐6, IL‐1, D dimer nên được xem xét để quyết định việc sử dụng thuốc chống viêm.
Mặc dù không có phương pháp điều trị chống viêm nào được FDA hoặc EMA (European Medicines Agency) chấp thuận cho điều trị SC‐2, nhưng cũng đã có báo cáo lâm sàng trong y văn và một số nghiên cứu lâm sàng đang được thực hiện. Trong số này, glucocorticoid, các chất ức chế miễn dịch, các chất đối kháng cytokine gây viêm, chẳng hạn như kháng thể đơn dòng IL-6R, chất ức chế TNF, chất đối kháng IL-1 và chất ức chế con đường Janus kinase (JAK) là những thuốc đang được quan tâm [1].
- Corticosteroid: Lợi ích của điều trị corticosteroid trong SC-2 vẫn còn nhiều tranh luận. Các nghiên cứu trước đây trên bệnh nhân SARS và MERS đã ghi nhận sự giảm thanh thải RNA của virus ở những bệnh nhân được điều trị bằng corticosteroid và không có sự khác biệt về tỷ lệ tử vong [110]. Ở bệnh nhân viêm phổi do cúm, sử dụng corticosteroid có liên quan đến tăng tỷ lệ tử vong [111]. Trong một nghiên cứu đoàn hệ tiến cứu trên 2141 bệnh nhân bị viêm phổi do virus cúm A (H1N1) [112] sử dụng liều corticosteroid thấp/trung bình (methylprednisolone 25–150 mg/ngày) đã chứng minh làm giảm tỷ lệ tử vong ở bệnh nhân có tỷ lệ SaO2/FiO2 300 mmHg. Trên cơ sở các nghiên cứu này và do thiếu bằng chứng, WHO khuyên không nên sử dụng corticosteroid trong viêm phổi do SC-2, trong khi vẫn xem xét khả năng nghiên cứu steroid như là một liệu pháp bổ sung [113]. Ở những bệnh nhân bị COVID-19 nặng nhưng không bị ARDS, bằng chứng trực tiếp từ hai nghiên cứu mô tả cung cấp bằng chứng chất lượng rất thấp về sự gia tăng tỷ lệ tử vong khi dùng corticosteroid [114]. Tuy nhiên, một nghiên cứu mô tả trên 84 bệnh nhân mắc SC-2 và ARDS cho thấy rằng liệu pháp corticosteroid có thể giảm tỷ lệ tử vong xuống 15% và giảm thời gian thở máy [115]. Russell và cs. đã nhấn mạnh khả năng sai lệnh nghiên cứu (bias) đối với các công bố đánh giá hiệu quả của corticosteroid trên bệnh lý hô hấp SC-2 khi sử dụng corticosteroid chỉ cho những bệnh nhân nguy kịch nhất. Theo Russell và cs. [116] bằng chứng lâm sàng không xác định không phải là lý do đủ để từ bỏ việc sử dụng corticosteroid trong viêm phổi do SC-2. Trên thực tế, các nghiên cứu khác đã có đánh giá tích cực việc sử dụng corticosteroid khi dùng ở liều thấp hoặc trung bình ở bệnh nhân coronavirus [115,117]. Một nghiên cứu ở Trung Quốc đã nhận thấy tác dụng thuận lợi của methylprednisolone trên 201 bệnh nhân SC-2 có ARDS [115].
Hướng dẫn quản lý ARDS của Mỹ (Faculty of Intensive Care Medicine và the Intensive Care Society) [118] đề nghị sử dụng methylprednisolone cho bệnh nhân ARDS giai đoạn đầu từ trung bình đến nặng (1mg/kg/ngày). Methylprednisolone nên được giảm từ từ (6–14 ngày) và không nhanh (2–4 ngày) hoặc đột ngột vì có thể xảy ra tình trạng xấu đi do phản ứng viêm tái phát. Sự giống nhau giữa bệnh cảnh SC-2 và ARDS do các bệnh lý khác cho thấy việc áp dụng cùng một phương pháp kháng viêm cũng hợp lý trong trường hợp viêm phổi nặng do SC-2. Các kết quả sơ bộ gần đây từ nghiên cứu RECOVERY cho thấy rằng dexamethasone liều thấp giúp giảm tử vong ở bệnh nhân SC-2 được thở máy, cũng như giảm tỷ lệ tử vong xuống 20% ở bệnh nhân được điều trị bằng oxy mặc dù không có lợi ích nào được quan sát thấy ở bệnh nhẹ hơn [119].
- Tocilizumab: Các nghiên cứu lâm sàng cho thấy mức độ tăng của cytokine ở bệnh nhân viêm phổi SC-2, đặc biệt là IL-6 (cũng như với IL-1, IL-2, IFN‐gamma, TNF‐α và IL-10) và tăng IL-6 có tương quan với mức độ nặng của bệnh [120]. Tocilizumab (TCZ) là kháng thể đơn dòng tái tổ hợp của người kháng IL-6. Thuốc liên kết với các thụ thể IL-6 hòa tan và thụ thể màng phong tỏa tín hiệu và phản ứng viêm qua trung gian IL-6. TCZ đã được phê duyệt để điều trị các bệnh thấp khớp, viêm khớp dạng thấp và đối với hội chứng giải phóng cytokine đe dọa tính mạng. Xiaoling và cs. [121] chỉ dùng TCZ (400 mg một lần TM) ở 20 bệnh nhân Trung Quốc bị viêm phổi SC‐ 2 cho thấy nhiệt độ trở lại bình thường, oxy được cải thiện 75% và hình mờ của tổn thương phổi trên CT xóa 90,5%. Một số nghiên cứu đánh giá sự an toàn và hiệu quả của TCZ trong điều trị viêm phổi do SC-2 nặng đang được thực hiện. Trong số các tác dụng phụ có thể có của TCZ trong điều trị SC-2 là hoại tử xương của hàm dưới, nhiễm trùng đường hô hấp trên, tăng cholesterol máu, giảm bạch cầu, giảm bạch cầu trung tính, đau bụng, loét miệng, viêm dạ dày, phù ngoại vi, mẫn cảm, viêm phổi kẽ, ho, thở khò khè, viêm kết mạc, tăng transaminase, nhức đầu, chóng mặt, tăng huyết áp, phát ban, ngứa và nổi ban [1].
- Eculizumab: Eculizumab (ECZ) là một kháng thể đơn dòng IgG được nhân tính hóa (humanized) bằng công nghệ DNA tái tổ hợp, ức chế bổ thể đầu cuối. Sau khi liên kết với protein bổ thể C5, thuốc ngăn chặn enzym phân cắt thành C5a và C5b và ngăn cản sự hình thành bổ thể đầu cuối phức hợp C5b ‐ 9 [122]. Sau khi sử dụng nhiều liều, trạng thái lâm sàng ổn định đạt được sau khoảng 49–56 ngày [122]. Kể từ khi có bằng chứng về cơn bão cytokine, ECZ đã được sử dụng trong viêm phổi do SC-2 với kết quả hứa hẹn ở bốn bệnh nhân nhập viện ICU vì viêm phổi nặng và ARDS ở Naples [123]. Tuy nhiên, nghiên cứu mới chỉ có số lượng bệnh nhân quá ít và cần có các nghiên cứu sâu hơn để xác định hiệu quả và độ
an toàn của thuốc trong viêm phổi nặng và ARDS do SC-2.
- Anakinra: Là một dạng tái tổ hợp của protein đối kháng thụ thể interleukin 1 ở người (IL‐1Ra) được bạch cầu đơn nhân và đại thực bào mô tiết ra, có vai trò điều chỉnh phản ứng miễn dịch bẩm sinh. Khi ngăn chặn thụ thể IL-1 sẽ ức chế phản ứng viêm. Do vậy, các tình huống nặng gặp trong “bão cytokine” cho thấy anakinra có thể là một thuốc điều trị tiềm năng cho bệnh nhân viêm phổi do SC-2 nặng. Trong một nghiên cứu gần đây các tác giả nhận thấy Anakinra làm giảm cả nhu cầu thở máy xâm lấn và tử vong ở bệnh nhân nặng do SC-2 và không có tác dụng phụ nghiêm trọng [124,125].
- Thuốc ức chế JAK (Janus kinase): JAK là một họ các tyrosine kinase nội bào, không thụ thể, truyền tín hiệu qua trung gian cytokine thông qua con đường JAK- STAT. Sự ức chế JAK có thể điều chỉnh cả chứng viêm và sự xâm nhập của virus vào tế bào. Trong SC-2, Richardson và cs. đã quan sát thấy ngoài ACE2, SC-2 lây nhiễm tế bào phổi cũng bằng cách sử dụng tế bào biểu mô phế nang. Một trong những chất điều hòa được biết đến của quá trình nội bào là AP2‐protein liên kết kinase 1 (AAK1). Sự phá vỡ AAK1 có thể làm gián đoạn quá trình truyền virus vào trong tế bào và quá trình lắp ráp các hạt virus bên trong tế bào. Trong số 378 chất ức chế AAK1 đã được biết, 47 chất đã được phê duyệt để sử dụng y tế và 6 chất ức chế AAK1 với ái lực cao. Một trong sáu loại thuốc liên kết AAK1 có ái lực cao là chất ức chế JAK, baricitinib. Tuy nhiên, chưa có dữ liệu nào trong y văn về điều trị thuốc này trong viêm phổi do SC-2.
KẾT LUẬN
Sau khoảng 2 năm tiếp cận đại dịch do SC-2, y học đã có những bước tiến dài trong sự hiểu biết về sinh bệnh học, chẩn đoán và điều trị viêm phổi do SC-2. Mặc dù vậy, vẫn còn nhiều câu hỏi về bệnh học và cách ứng xử viêm phổi do SC-2 trong thời gian tới cần được làm sáng tỏ. Trong xử trí, do tình hình cấp bách của dịch bệnh, nhiều thuốc và cách tiếp cận xử trí đã được phê duyệt khẩn cấp không theo quy trình chuẩn đang đòi hỏi cần có các đánh giá kịp thời để bổ sung cho những khoảng trống mà y học còn chưa biết. Một trong những vấn đề rất được quan tâm và cần được làm sáng tỏ là tác động lâu dài sau viêm phổi do SC-2 như thế nào trên người khỏe cũng như trên người có bệnh phổi mạn tính.
Tài liệu tham khảo
1. Caterina Sagnelli, Benito Celia, Caterina Monari et al. Management of SARS‐CoV‐2 pneumonia. J Med Virol. 2021;93:1276–1287.
2. Mingkun Li, Lili Ren, Yeming Wang et al. Dynamics of the upper respiratory tract microbiota and its association with fatality in COVID-19 patients (preliminary version). Research Square. DOI: 10.21203/rs.3.rs-95239/v1 (online)
3. National Institutes of Health (NHI - US). Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. Overview of COVID-19. Last Updated: July 8, 2021. https://www.covid19treatmentguidelines.nih.gov (online)
4. C. Chakraborty et al. SARS-CoV-2 causing pneumonia-associated respiratory disorder (COVID-19): diagnostic and proposed therapeutic options. European Review for Medical and Pharmacological Sciences. 2020; 24: 4016-4026
5. Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for the recognition of SARS- CoV-2 by full-length human ACE2. Science 2020;367:1444-8. doi: 10.1126/science.abb2762 pmid: 32132184
6. Cevik M, Bamford CGG, Ho A. COVID-19 pandemic-a focused review for clinicians. Clin Microbiol Infect 2020;26:842-7. doi: 10.1016/j.cmi.2020.04.023 pmid: 32344166
7. Wölfel R, Corman VM, Guggemos W, et al. Virological assessment of hospitalized patients with COVID-2019. Nature 2020;581:465-9. doi: 10.1038/s41586-020-2196-x pmid:
32235945
8. Hui KPY, Cheung MC, Perera RAPM, et al. Tropism, replication competence, and innate immune responses of the coronavirus SARS-CoV-2 in human respiratory tract and conjunctiva: an analysis in ex-vivo and in-vitro cultures. Lancet Respir Med 2020;8:687-95. doi: 10.1016/S2213-2600(20)30193-4 pmid: 32386571
9. Muge Cevik, et al. Virology, transmission, and pathogenesis of SARS-CoV-2. BMJ 2020;371:m3862 http://dx.doi.org/10.1136/bmj.m3862
10. Cevik M, Marcus J, Buckee C, Smith T. SARS-CoV-2 transmission dynamics should inform policy Clin Infec Dis;2020, doi: 10.1093/cid/ciaa1442.
11. Klompas M, Baker MA, Rhee C. Airborne transmission of SARS-CoV-2: theoretical considerations and available evidence. JAMA 2020;324:441-2. doi: 10.1001/jama.2020.12458 pmid: 32749495
12. Yu IT, Li Y, Wong TW, etal. Evidence of airborne transmission of the severe acute respiratory syndrome virus. N Engl J Med 2004;350:1731-9. doi: 10.1056/NEJMoa032867 pmid: 15102999
13. Li et al. Expression of the SARS-CoV-2 cell receptor gene ACE2 in a wide variety of human tissuesInfectious Diseases of Poverty (2020) 9:45
14. Ren et al. Comparison of acute pneumonia caused by SARS-COV-2 and other respiratory viruses in children: a retrospective multi-center cohort study during COVID-19 outbreakMilitary Medical Research (2021) 8:13
15. Mangalmurti N, Hunter CA. Cytokine Storms: understanding COVID-19. Immunity 2020;53:19-25. doi: 10.1016/j.immuni.2020.06.017 pmid: 32610079
16. Blanco-Melo D, Nilsson-Payant BE, Liu W-C, etal. Imbalanced host response to SARS- CoV-2 drives development of covid-19. Cell 2020;181:1036-1045.e9. doi: 10.1016/j.cell.2020.04.026 pmid: 32416070
17. Menezes et al. SARS-CoV-2 pneumonia - receptor binding and lung immunopathology: a narrative review Crit Care (2021) 25:53
18. Om Prakash Mehta et al. Coronavirus Disease (COVID-19): Comprehensive Review of Clinical Presentation. Front. Public Health, 15 January 2021| https://doi.org/10.3389/fpubh.2020.582932
19. Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med 2020;8:420-2. doi: 10.1016/S2213- 2600(20)30076-X pmid: 32085846
20. Carsana L, Sonzogni A, Nasr A, et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infect Dis 2020;20:1135-40. doi: 10.1016/S1473-3099(20)30434-5 pmid: 32526193
21. Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med 2020;180:934-43. doi: 10.1001/jamainternmed.2020.0994 pmid: 32167524
22. Liu Y, Yan L-M, Wan L, et al. Viral dynamics in mild and severe cases of COVID-19. Lancet Infect Dis 2020;20:656-7. doi: 10.1016/S1473-3099(20)30232-2 pmid: 32199493
23. Cevik M, Tate M, Lloyd O, et al. SARS-CoV-2, SARS-CoV-1 and MERS-CoV viral load dynamics, duration of viral shedding and infectiousness: a living systematic review and meta-analysis. Lancet Microbe 2020; (forthcoming) doi: 10.1016/S2666-5247(20)30172-5.
24. Lili Ren et al. Dynamics of the Upper Respiratory Tract Microbiota and its Association with Mortality in COVID-19. AJRCCM Articles in Press. Published September 17, 2021 as 10.1164/rccm.202103-0814OC Copyright © 2021 by the American Thoracic Society
25. Chiagozie O. Pickens et al. Bacterial superinfection pneumonia in SARS-CoV-2 respiratory failure. medRxiv preprint doi: https://doi.org/10.1101/2021.01.12.20248588; this version posted January 15, 2021.
26. Contou et al. Ann. Bacterial and viral co-infections in patients with severe SARS-CoV-2 pneumonia admitted to a French ICU. Intensive Care (2020) 10:119
27. Tobin MJ, Laghi F, Jubran A. Why COVID-19 silent hypoxemia is baffling to physicians. Am J Respir Crit Care Med 2020;202:356–60.
28. Couzin-Frankel J. The mystery of the pandemic's 'happy hypoxia'. Science 2020;368:455–6.
29. Kory P, Kanne JP. SARS-CoV-2 organising pneumonia: ‘Has there been a widespread failure to identify and treat this prevalent condition in COVID-19?’. BMJ Open Resp Res 2020;7:e000724. doi:10.1136/ bmjresp-2020-000724
30. Copin M-C, Parmentier E, Duburcq T, et al. Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. Intensive Care Med 2020;46:1124–6.
31. Magro C, Mulvey JJ, Berlin D, et al. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: a report of five cases. Transl Res 2020;220:1–13
32. Polak SB, Van Gool IC, Cohen D, et al. A systematic review of pathological findings in COVID-19: a pathophysiological timeline and possible mechanisms of disease progression. Modern Pathol 2020;579.
33. Bradley BT, Maioli H, Johnston R, et al. Histopathology and ultrastructural findings of fatal COVID-19 infections. medRxiv 2020
34. Shi H, Han X, Jiang N, et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis 2020. 26 Horby P, Lim WS, Embers
35. Who-China-Joint-Mission-on-Covid-19-Final-Report.pdf. Available online at: https://www.who.int/docs/default-source/coronaviruse/who-china-jointmission-on-covid-19-final-report.pdf (accessed June 1, 2020).
36. Kakodkar P, Kaka N, Baig M. A comprehensive literature review on the clinical presentation, and management of the pandemic coronavirus disease 2019 (COVID-19). Cureus. (2020) 12:e7560. doi: 10.7759/cureus.7560
37. Ottestad W, Seim M, Mæhlen JO. COVID-19 with silent hypoxemia. Tidsskr Den NorLegeforening. (2020) 140. doi: 10.4045/tidsskr.20.0299
38. Couzin-Frankel J. The mystery of the pandemic’s “happy hypoxia.” Science. (2020) 368:455–6. doi: 10.1126/science.368.6490.455
39. Guan W, Ni Z, Hu Y, Liang W, Ou C, He J, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. (2020) 382:1708–20. doi: 10.1056/NEJMoa2002032
40. Ye Z, Zhang Y, Wang Y, Huang Z, Song B. Chest CT manifestations of new coronavirus disease 2019 (COVID-19): a pictorial review. Eur Radiol. (2020) 30:4381–9. doi: 10.1007/s00330-020-06801-0
41. Tong JY, Wong A, Zhu D, Fastenberg JH, Tham T. The prevalence of olfactory and gustatory dysfunction in COVID-19 patients: a systematic review and meta-analysis. Otolaryngol Neck Surg. (2020) 163:3–11. doi: 10.1177/0194599820926473
42. Akhmerov A, Marbán E. COVID-19 and the Heart. Circ Res. (2020) 126:1443– 55. doi: 10.1161/CIRCRESAHA.120.317055
43. Kochi AN, Tagliari AP, Forleo GB, Fassini GM, Tondo C. Cardiac and arrhythmic complications in patients with COVID-19. J Cardiovasc Electrophysiol. (2020) 31:1003–8. doi: 10.1111/jce.14479
44. Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus–infected pneumonia in Wuhan, China. JAMA. (2020) 323:1061–9. doi: 10.1001/jama.2020.1585
45. Patients Taking ACE-i and ARBs who Contract COVID-19 Should Continue Treatment, Unless Otherwise Advised by Their Physician. American Heart Association (2020). Available online at: https://newsroom.heart.org/ news/patients-taking-ace-i-and-arbs-who-contract-covid-19-shouldcontinue-treatment-unless-otherwise-advised-by-their-physician (accessed June 27, 2020).
46. Hasan SS, Kow CS, Hadi MA, Zaidi STR, Merchant HA. Mortality and disease severity among COVID-19 patients receiving reninangiotensin system inhibitors: a systematic review and meta-analysis. Am J Cardiovasc Drugs. (2020). doi: 10.22541/au.158880148.8425 0526. [Epub ahead of print].
47. Tian Y, Rong L, Nian W, He Y. Review article: gastrointestinal features in COVID-19 and the possibility of faecal transmission. Aliment Pharmacol Ther. (2020) 51:843–51. doi: 10.1111/apt.15731
48. An P, Chen H, Jiang X, Su J, Xiao Y, Ding Y, et al. Clinical Features of 2019 Novel Coronavirus Pneumonia Presented Gastrointestinal Symptoms But Without Fever Onset. Rochester, NY: Social Science Research Network (2020). Available online at: https://papers.ssrn.com/abstract=3532530 (accessed June 27, 2020). doi: 10.2139/ssrn.3532530
49. Pan L, Mu M, Yang P, Sun Y, Wang R, Yan J, et al. Clinical characteristics of covid-19 patients with digestive symptoms in hubei, china: a descriptive, cross-sectional, multicenter study. Am J Gastroenterol. (2020) 115, 766–73. doi: 10.14309/ajg.0000000000000620
50. Hirsch JS, Ng JH, Ross DW, Sharma P, Shah HH, Barnett RL, et al. Acute kidney injury in patients hospitalized with COVID-19. Kidney Int. (2020) 98:209–18. doi: 10.1016/j.kint.2020.05.006
51. Sheraton M, Deo N, Kashyap R, Surani S. A review of neurological complications of COVID-19. Cureus. (2020) 12:e8192. doi: 10.7759/cureus.8192
52. Bridwell R, Long B, Gottlieb M. Neurologic complications of COVID-19. Am J Emerg Med. (2020) 38:1549.e3–7. doi: 10.1016/j.ajem.2020.05.024
53. Mao L, Jin H, Wang M, Hu Y, Chen S, He Q, et al. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol. (2020) 77:683–90. doi: 10.1001/jamaneurol.2020.1127
54. Ghannam M, Alshaer Q, Al-Chalabi M, Zakarna L, Robertson J, Manousakis G.
Neurological involvement of coronavirus disease 2019: a systematic review. J Neurol. (2020). doi: 10.21203/rs.3.rs-31183/v1. [Epub ahead of print].
55. Cipollaro L, Giordano L, Padulo J, Oliva F, Maffulli N. Musculoskeletal symptoms in SARS- CoV-2 (COVID-19) patients. J Orthop Surg. (2020) 15:178. doi: 10.1186/s13018-020-01702-w
56. Chan KH, Farouji I, Hanoud AA, Slim J. Weakness and elevated creatinine kinase as the initial presentation of coronavirus disease 2019 (COVID-19). Am J Emerg Med. (2020) 38:1548.e1–3. doi: 10.1016/j.ajem.2020.05.015
57. López-González M-C, Peral-Garrido ML, Calabuig I, Tovar-Sugrañes E, Jovani V, Bernabeu P, et al. Case series of acute arthritis during COVID-19 admission. Ann Rheum Dis. (2020) doi: 10.1136/annrheumdis-2020-217914. [Epub ahead of print].
58. Qu R, Ling Y, Zhang Y, Wei L, Chen X, Li X, et al. Platelet-to-lymphocyte ratio is associated with prognosis in patients with coronavirus disease-19. J Med Virol. (2020) 92:1533–41. doi: 10.1002/jmv.25767
59. Levi M, Thachil J, Iba T, Levy JH. Coagulation abnormalities and thrombosis in patients with COVID-19. Lancet Haematol. (2020) 7:e438–40. doi: 10.1016/S2352-3026(20)30145-9
60. Aziz M, Fatima R, Assaly R. Elevated interleukin-6 and severe COVID-19: a meta-analysis. J Med Virol. (2020) 92:2283–5. doi: 10.1002/jmv.25948
61. Rodríguez-Molinero A, Gálvez-Barrón C, Miñarro A, Macho O, López GF, Robles MT et al. Association between COVID-19 prognosis and disease presentation, comorbidities and chronic treatment of hospitalized patients. PLoS ONE. (2020) 15:e0239571. doi: 10.1371/journal.pone.0239571
62. Frija-Masson J, Debray M-P, Gilbert M, et al. Functional characteristics of patients with SARS-CoV-2 pneumonia at 30 days post-infection. Eur Respir J 2020; 56: 2001754 [https://doi.org/ 10.1183/13993003.01754-2020].
63. Salehi S, Abedi A, Balakrishnan S, Gholamrezanezhad A. Coronavirus disease 2019 (COVID-19): a systematic review of imaging findings in 919 patients. AJR Am J Roentgenol. 2020;215:1–7
64. Kim JY, Choe PG, Oh Y, Oh KJ, Kim J, Park SJ, et al. The first case of 2019 novel coronavirus pneumonia imported into Korea from Wuhan China: implication for infection prevention and control measures. J Korean Med Sci. 2020; 35:e61
65. Pan Y, Guan H, Zhou S, Wang Y, Li Q, Zhu T, et al. Initial CT findings and temporal changes in patients with the novel coronavirus pneumonia (2019-nCoV): a study of 63 patients in Wuhan, China. Eur Radiol. 2020, http://dx.doi.org/10.1007/s00330-020-06731- x.
66. Xie X, Zhong Z, Zhao W, Zheng C, Wang F, Liu J. Chest CT for typical 2019-nCoV pneumonia: relationship to negative RT-PCR testing. Radiology. 2020:200343, http://dx.doi.org/10.1148/radiol.2020200343.
67. Huang P, Liu T, Huang L, Liu H, Lei M, Xu W, et al. Use of chest CT in combination with negative RT-PCR assay for the 2019 novel coronavirus but high clinical suspicion. Radiology. 2020;295:22–3
68. Jin YH, Cai L, Cheng ZS, Cheng H, Deng T, Fan YP, et al. A rapid advice guideline for the diagnosis and treatment of 2019 novel coronavirus (2019-nCoV)infected pneumonia (standard version). Mil Med Res. 2020;7.
69. Ye Z, Zhang Y, Wang Y, huang Z, Song B. Chest CT manifestations of new coronavirus disease 2019 (COVID-19): a pictorial review. Eur Radiol. 2020, http://dx.doi.org/10.1007/s00330-020-06801-0.
70. Pan F, Ye T, Sun P, Gui S, Liang B, Li L, et al. Time course of lung changes on chest CT during recovery from 2019 novel coronavirus (COVID-19) pneumonia. Radiology. 2020, http://dx.doi.org/10.1148/radiol.2020200370.
71. Lei J, Li J, Li X, Qi X. CT imaging of the 2019 novel coronavirus (2019-nCoV) pneumonia. Radiology. 2020, http://dx.doi.org/10.1148/radiol.2020200236.
72. Rui Zhang et al. CT features of SARS-CoV-2 pneumonia according to clinical presentation: a retrospective analysis of 120 consecutive patients from Wuhan city. European Radiology (2020) 30:4417–4426
73. Liu D, Li L,WuX, Zheng D,Wang J,Yang L, et al. Pregnancy andperinatal outcomes of women with coronavirus disease (COVID-19) pneumonia: a preliminary analysis. AJR Am J Roentgenol. 2020;18:1–6
74. Song F, Shi N, Shan F, Zhang Z, Shen J, Lu H, et al. Emerging coronavirus (2019-nCoV) pneumonia. Radiology. 2020, http://dx.doi.org/10.1148/radiol.2020200274.
75. Cheng Z, Lu Y, Cao Q, Qin L, Pan Z, Yan F, et al. Clinical features and chest ct manifestations of coronavirus disease 2019 (COVID-19)in a Single-Center Study in Shanghai, China. AJR Am J Roentgenol. 2020;215:1–6.
76. Taisheng Li (2020) Diagnosis and clinical management of severe acute respiratory syndrome Coronavirus 2 (SARS-CoV-2) infection: an operational recommendation of Peking Union Medical College Hospital (V2.0), Emerging Microbes & Infections, 9:1, 582-585, DOI: 10.1080/22221751.2020.1735265
77. National Health Commission. The guidelines for the diagnosis and treatment of severe acute respiratory syndrome coronavirus 2(SARS-CoV-2) infection (Pilot 3rd version) [S/OL].(2020-01-22)[2020-01-22]. From: http://www.nhc.gov.cn/xcs/zhengcwj/202001/ f492c9153ea9437bb587ce2ffcbee1fa/files/39e7578d8596 4dbe81117736dd789d8f.pdf.
78. Devaux CA, Rolain JM, Colson P, Raoult D. New insights on the antiviral effects of chloroquine against coronavirus: what to expect for COVID‐19? Int J Antimicrob Agents. 2020;55:105938. https:// doi.org/10.1016/j.ijantimicag.2020.105938
79. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Pharmacologic treatments for coronavirus disease 2019 (COVID‐19): a Review. JAMA. 2020;323(18):1824‐1836. https://doi.org/10.1001/jama.2020.6019
80. Patrì A, Fabbrocini G. Hydroxychloroquine and ivermectin: a synergistic combination for COVID‐19 chemoprophylaxis and treatment? J Am Acad Dermatol. 2020;82(6):e221. https://doi.org/ 10.1016/j.jaad.2020.04.017
81. Fontana F, Alfano G, Mori G, et al. COVID‐19 pneumonia in a kidney transplant recipient successfully treated with tocilizumab and hydroxychloroquine. Am J Transplant. 2020;20(7):1902‐1906. https://doi.org/10.1111/ajt.1593
82. Costanzo M, De Giglio MAR, Roviello GN. SARS‐CoV‐2: recent Reports on antiviral therapies based on lopinavir/ritonavir, darunavir/umifenovir, hydroxychloroquine, remdesivir, favipiravir and other drugs for the treatment of the new coronavirus. Curr Med Chem. 2020;27(27):4536‐4541. https:// doi.org/10.2174/0929867327666200416131117
83. Guastalegname M, Vallone A. Could chloroquine /hydroxychloroquine be harmful in coronavirus disease 2019 (COVID‐19) treatment? Clin Infect Dis. 2020;71(15):888‐889. https://doi.org/10. 1093/cid/ciaa321
84. Zhou D, Dai SM, Tong Q. COVID‐19: a recommendation to examine the effect of hydroxychloroquine in preventing infection and progression. J Antimicrob Chemother. 2020;75:1667‐1670. https:// doi.org/10.1093/jac/dkaa114
85. Yao X, Ye F, Zhang M, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS‐ CoV‐2). Clin Infect Dis. 2020;71:732‐739. https://doi.org/10.1093/cid/ciaa237
86. WHO. “Solidarity” clinical trial for COVID‐19 treatments. 2020. 87. Oxford University U RECOVERY trial ‐ Randomized Evaluation of COVID‐10 therapy. 2020.
88. Oxford University U No clinical benefit from use of lopinavir‐ ritonavir in hospitalised COVID‐19 patients studied in RECOVERY. 2020
89. Institut National de la Santé Et de la Recherche Médicale F. Trial of Treatments for COVID‐19 in Hospitalized Adults (DisCoVeRy). 2020.
90. Chen F, Chan KH, Jiang Y, et al. In vitro susceptibility of 10 clinical isolates of SARS coronavirus to selected antiviral compounds. J Clin Virol. 2004. https://doi.org/10.1016/j.jcv.2004.03.003
91. Chu CM, Cheng VC, Hung IF, et al. HKU/UCH SARS Study Group. Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings. Thorax. 2004. https://doi.org/10. 1136/thorax.2003.012658
92. Nukoolkarn V, Lee VS, Malaisree M, Aruksakulwong O, Hannongbua S. Molecular dynamic simulations analysis of ritonavir and lopinavir as SARS‐CoV 3CL(pro) inhibitors. J Theor Biol. 2008; 254:861‐867. https://doi.org/10.1016/j.jtbi.2008.07.030
93. de Wilde AH, Jochmans D, Posthuma CC, et al. Screening of an FDA‐approved compound library identifies four small‐molecule inhibitors of Middle East respiratory syndrome coronavirus replication in cell culture. Antimicrob Agents Chemother. 2014;58: 4875‐4884.
94. Choy KT, Wong AY, Kaewpreedee P, et al. lopinavir, emetine, and homoharringtonine inhibit SARS‐CoV‐2 replication in vitro. Antiviral Res. 2020. https://doi.org/10.1016/j.antiviral.2020.104786
95. Chan KS, Lai ST, Chu CM, et al. Treatment of severe acute respiratory syndrome with lopinavir/ritonavir: a multicentre retrospective matched cohort study. Hong Kong Med J. 2003;9:399‐406
96. Yao TT, Qian JD, Zhu WY, Wang Y, Wang GQ. A systematic review of lopinavir therapy for SARS coronavirus and MERS coronavirus‐ A possible reference for coronavirus disease‐19 treatment option. J Med Virol. 2020;92:556‐563. https://doi.org/10.1002/jmv.25729
97. Cao B, Wang Y, Wen D, et al. A trial of lopinavir‐ritonavir in adults hospitalized with severe covid‐19. N Engl J Med. 2020;382: 1787‐1799.
98. Dong L, Hu S, Gao J. Discovering drugs to treat coronavirus disease 2019 (COVID‐19). Drug Discov Ther. 2020;14:58‐
99. Agostini ML, Andres EL, Sims AC, et al. Coronavirus susceptibility to the antiviral remdesivir (GS‐5734) is mediated by the viral polymerase and the proofreading exoribonuclease. mBio. 2018; 9(2):e00221‐e00318. https://doi.org/10.1128/mBio.00221-18
100. Pizzorno A, Padey B, Julien T, et al. Characterization and treatment of SARS‐CoV‐2 in nasal and bronchial human airway epithelia. Cell Rep Med. 2020;1(4):100059. https://doi.org/10.1016/j.xcrm.2020. 100059
101. Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019‐ nCoV) in vitro. Cell Res. 2020;30:269‐271
102. Williamson BN, Feldmann F, Schwarz B, et al. Clinical benefit of remdesivir in rhesus macaques infected with SARS‐CoV‐2. Nature. 2020. https://doi.org/10.1038/s41586-020-2423-5
103. Grein J, Ohmagari N, Shin D, et al. Compassionate use of remdesivir for patients with severe covid‐19. N Engl J Med. 2020;382: 2327‐2336
104. Wang Y, Zhang D, Du G, et al. Remdesivir in adults with severe COVID‐19: a randomised, double‐blind, placebo‐controlled, multicentre trial. Lancet. 2020;395:1569‐1578
105. Beigel JH, Tomashek KM, Dodd LE, et al. ACTT‐1 Study Group Members. Remdesivir for the Treatment of Covid‐19 ‐ Preliminary Report. N Engl J Med. 2020. https://doi.org/10.1056/NEJMoa2007764
106. FDA U.S.F.a.D.A., Remdesivir EUA Letter of Authorization ‐ FDA. 2020.
107. WHO. Clinical management of COVID‐19. Interim guidance, 27 May 2020.
108. CDC. Information for Clinicians on Investigational Therapeutics for Patients with COVID‐19. Available online: https://www.cdc.gov/ coronavirus/2019-ncov/hcp/therapeutic-options.html. Accessed on 3 June 2020
109. JHMI Clinical Recommendations for Pharmacologic Treatment of COVID-19 Updated 7/7/2021 andreplaces the version of June 9, 2021; COVID-19 Treatment Guidance Writing Group of Johns Hopkins University and The Johns Hopkins Hospital COVID-19 Treatment Guidance Working Group. https://www.hopkinsguides.com/hopkins/ub?cmd
110. Arabi YM, Mandourah Y, Al‐Hameed F, et al, Saudi Critical Care Trial Group. Corticosteroid therapy for critically ill patients with middle east respiratory syndrome. Am J Respir Crit Care Med. 2018; 197(6):757‐767. https://doi.org/10.1164/rccm.201706-1172OC
111. Ni YN, Chen G, Sun J, Liang BM, Liang ZA. The effect of corticosteroids on mortality of patients with influenza pneumonia: a systematic review and meta‐analysis. Crit Care.2019;23:99. https://doi.org/10.1186/s13054-019-2395-8
112. Siemieniuk RAC, Meade MO, Alonso‐Coello P, et al. Corticosteroid therapy for patients hospitalized with community‐acquired pneumonia: a systematic review and meta‐analysis. Ann Intern Med. 2015;163:519‐528.
113. COVID‐19 Public Health Emergency of International Concern (PHEIC) Global research and innovation forum: towards a research roadmap. Available online: https://www.who.int/blueprint/prioritydiseases/key- action/Global_Research_Forum_FINAL_VERSION_ for_web_14_feb_2020.pdf?ua=1
114. Li X, Xu S, Yu M, et al. Risk factors for severity and mortality in adult COVID‐19 inpatients in Wuhan. J Allergy Clin Immunol. 2020; 146(1):110‐118. https://doi.org/10.1016/j.jaci.2020.04.006
115. Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan China. JAMA Intern Med.. 2020; 180(7):1‐11. https://doi.org/10.1001/jamainternmed.2020.0994
116. Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019‐nCoV lung injury. Lancet. 2020; 395:473‐475. https://doi.org/10.1016/S0140-6736(20)30317-2
117. Li H, Yang SG, Gu L, et al. National Influenza A (H1N1) pdm09 Clinical Investigation Group of China. Effect of low‐to‐moderate‐dose corticosteroids on mortality of hospitalized adolescents and adults with influenza A(H1N1)pdm09 viral pneumonia. Influenza Other Respir Viruses. 2017;11(4):345‐354. https://doi.org/10.1111/ irv.12456
118. FICM. Guidelines on the management of acute respiratory distress syndrome. Version 1, July 2018. Available online: https://www. ficm.ac.uk/sites/default/files/ficm_ics_ards_guideline_-_july_2018. pdf. Accessed July 2, 2020.
119. Horby P, Lim WS, Emberson J, et al., RECOVERY Collaborative Group None. Effect of dexamethasone in hospitalized patients with covid‐19: preliminary report. medRxiv. 2020. https://doi.org/10. 1101/2020.06.22.20137273
120. Liu T, Zhang J, Yang Y, et al. The role of interleukin‐6 in monitoring severe case of coronavirus disease 2019. EMBO Mol Med. 2020; 12(7):e12421. https://doi.org/10.15252/emmm.202012421
121. Xu X, Han M, Li T, et al. Effective treatment of severe COVID‐19 patients with tocilizumab. Proc Natl Acad Sci USA. 2020;117: 10970‐10975. https://doi.org/10.1073/pnas.2005615117
122. Hillmen P, Young NS, Schubert J, et al. The complement inhibitor eculizumab in paroxysmal nocturnal hemoglobinuria. N Engl J Med. 2006;355:1233‐1243. https://doi.org/10.1056/NEJMoa061648
123. Diurno F, Numis FG, Porta G, et al. Eculizumab treatment in patients with COVID‐19: preliminary results from real life ASL Napoli 2 Nord experience. Eur Rev Med Pharmacol Sci. 2020;24:4040‐4047.
124. Huet T, Beaussier H, Voisin O, et al. Anakinra for severe forms of COVID‐19: a cohort study. Lancet Rheumatol. 2020. https://doi.org/ 10.1016/S2665-9913(20)30164-8
125. Pontali E, Volpi S, Antonucci G, et al. Safety and efficacy of early high‐dose IV anakinra in severe COVID‐19 lung disease. J Allergy Clin Immunol. 2020;146(1):213‐215. https://doi.org/10.1016/j.jaci. 2020.05.002
---
(*) TS.BS Nguyễn văn Thành. PCT Hội Phổi VN, PCT Hội Hô hấp VN. Cán bộ giảng Bộ môn Nội ĐH Y-D Cần Thơ. E-mail: drthanhbk@gmail.com
Tác giả không có mâu thuẫn lợi ích liên quan tới nội dung bài viết cần khai báo.